शब्द "सहसंयोजक लिंक" स्वयं दो लैटिन शब्दों से मिलता-जुलता है: "सह" - सर्पिल और "वेल्स" - मेरे पास शक्ति है, इसके लिए, इलेक्ट्रॉनों की एक जोड़ी के बजने के लिए, यह एक घंटे की तरह दिखता है, परमाणुओं के बीच की अंगूठी इलेक्ट्रॉनों के एक बराबर का एक रखुनोक, जैसे zagalnye їm)। सहसंयोजक लिंक की स्थापना केवल गैर-धातुओं के परमाणुओं के बीच की जाती है, और यह अणुओं के परमाणुओं के साथ-साथ क्रिस्टल में भी पाई जा सकती है।
पहली बार, सहसंयोजक गेंद को दूर 1916 में अमेरिकी रसायनज्ञ जे. लुईस द्वारा प्रकट किया गया था, और एक घंटे के लिए, विचार, विचार, प्रयोगात्मक रूप से पुष्टि किए गए लोगों से वंचित थे। केमिस्ट ड्राइव पर कैसे गए? और वे, कि गैर-धातुओं की विद्युतीयता महान तक पहुंच जाएगी और जब दो परमाणुओं के रासायनिक अंतर्संबंध को स्थानांतरित किया जाता है, तो एक से अंतिम तक के इलेक्ट्रॉनों की सलाह नहीं दी जा सकती है, उसी क्षण उनके साथ परस्पर संबंध होना आवश्यक है .
टिपी सहसंयोजक लिंक
Zagalom दो प्रकार की सहसंयोजक कड़ी:
- घिनौना,
- दाता-स्वीकृति।
जब त्वचा के परमाणुओं और परमाणुओं के बीच सहसंयोजक लिंक का आदान-प्रदान होता है, तो इसे एक अप्रकाशित इलेक्ट्रॉन के लिए इलेक्ट्रॉनिक लिंक में प्रस्तुत किया जाता है। बहुत सारे इलेक्ट्रॉनिक्स के साथ, मां एंटी-चार्ज चार्ज (बैक) के लिए जिम्मेदार होती है।
एक समान सहसंयोजक लिंक को जोड़ने के साथ, एक लिंक का उपयोग किया जा सकता है जो पानी के अणुओं को अवशोषित करने की अनुमति देता है। यदि परमाणु निकट आते हैं, तो इलेक्ट्रॉनिक मुस्कान केवल एक में प्रवेश करती है, नौटसी को इलेक्ट्रॉनिक मुस्कान का पुनर्लेखन कहा जाता है। याक वंशानुक्रम, नाभिक के बीच इलेक्ट्रॉनिक गस्टिन बढ़ता है, बदबू एक से एक को आकर्षित करती है, और सिस्टम की ऊर्जा बदल जाती है। टिम कम से कम नहीं हैं, कोर के साथ निकटता के साथ, वे उन्हें ठीक कर सकते हैं, और इस तरह के रैंक के साथ उन्हें उनके बीच देखना इष्टतम है।
यह वास्तव में चित्र में दिखाया गया है।

दाता-स्वीकर्ता प्रकार के सहसंयोजक लिंक से पहले, यदि एक भाग जुड़ा हुआ है, तो दाता लिंक के लिए अपनी इलेक्ट्रॉनिक जोड़ी प्रस्तुत करता है, और स्वीकर्ता - आभासी कक्षीय।
साथ ही सहसंयोजक लिंक के प्रकार की बात करें तो आप गैर-ध्रुवीय और ध्रुवीय सहसंयोजक लिंक देख सकते हैं, उनके बारे में अधिक विवरण नीचे लिखा गया है।
सहसंयोजक गैर-ध्रुवीय लिंक
एक सहसंयोजक गैर-ध्रुवीय लिंक का मूल्य केवल एक लिंक है, जो दो समान परमाणुओं के बीच स्थापित होता है। एक गैर-ध्रुवीय सहसंयोजक लिंक का आवेदन नीचे दिए गए आरेख में आश्चर्यजनक है।
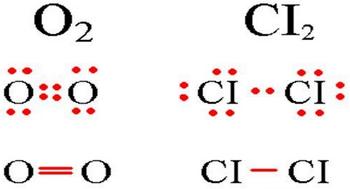
एक सहसंयोजक गैर-ध्रुवीय लिंक का आरेख।
अणुओं में, एक सहसंयोजक गैर-ध्रुवीय लिंक के साथ, बाहरी इलेक्ट्रॉनिक दांव परमाणुओं के नाभिक से समान दूरी पर सिकुड़ते हैं। उदाहरण के लिए, अणु खटास (आरेख पर) में, परमाणु आठ इलेक्ट्रॉनिक विन्यास से भरे होते हैं, पूरी बदबू के साथ इलेक्ट्रॉनिक समानता के विकल्प हो सकते हैं।
एक सहसंयोजक गैर-ध्रुवीय वलय वाली नदियों के साथ, गैस, या कभी-कभी कम पिघलने वाले ठोस भाषण के साथ।
सहसंयोजक ध्रुवीय लिंक
अब कनेक्शन सहसंयोजक ध्रुवीकृत है। फिर से, सहसंयोजक ध्रुवीय लिंक स्थापित होता है, यदि सहसंयोजक जुड़े परमाणु विद्युत रूप से नकारात्मक नहीं हो सकते हैं, और निलंबित इलेक्ट्रॉन दो परमाणुओं के साथ ओवरलैप नहीं करते हैं। एक घंटे से अधिक समय तक, विशाल इलेक्ट्रॉनिक्स एक परमाणु के करीब होते हैं, अंतिम के नहीं। एक सहसंयोजक ध्रुवीय लिंक के अतिरिक्त, क्लोरीन पानी के अणुओं में पाए जाने वाले लिंक हो सकते हैं, विशाल इलेक्ट्रॉनिक्स हैं, एक सहसंयोजक लिंक की स्थापना के लिए, यह क्लोरीन परमाणु के करीब बढ़ सकता है, पानी नहीं। और दाईं ओर यह है कि क्लोरीन पानी की तुलना में विद्युत रूप से अधिक नकारात्मक है।

तो एक सहसंयोजक ध्रुवीय लिंक के viglyadaє आरेख।
चलो एक ध्रुवीय सहसंयोजक लिंक є पानी के साथ भाषण के बट को खरोंचते हैं।
याक एक सहसंयोजक कड़ी की तुलना में
खैर, अब आप जानते हैं कि कैसे खाना है क्योंकि एक सहसंयोजक ध्रुवीय संबंध है, गैर-ध्रुवीय के रूप में, शक्ति के सभी बड़प्पन के लिए और रसायन शास्त्र सूत्रअणु, यदि एक अणु अलग-अलग तत्वों के परमाणुओं में मुड़ा हुआ है, तो लिंक ध्रुवीय होगा, जैसे एक तत्व से, तो यह गैर-ध्रुवीय होगा। यह भी याद रखना महत्वपूर्ण है कि अधातुओं के मध्य से सहसंयोजक कड़ियाँ खो सकती हैं, सहसंयोजक कड़ियों के तंत्र के कारण ही हम इसका वर्णन करेंगे।
सहसंयोजक लिंक, वीडियो
हमारे क़ानून के विषय के बारे में वीडियो व्याख्यान के अंत में, सहसंयोजक लिंक।
सहसंयोजक कड़ी चुटीली कड़ियों की एक श्रृंखला है, जो इलेक्ट्रॉनिक जोड़े के रैकेट होने का दिखावा कर सकती है।
H2 अणु के बट से सहसंयोजक लिंक स्थापित करने की क्रियाविधि स्पष्ट रूप से दिखाई देती है। परमाणुओं को इलेक्ट्रॉनिक सूत्र का उपयोग करके पाया जा सकता है: 1H1s1।
जब दो परमाणु एक-दूसरे के करीब होते हैं, तो दो इलेक्ट्रॉन एक पिछड़े (उप-विभाजित) इलेक्ट्रॉनिक दांव के रूप में एंटीपैरलल स्पिन (अन्य स्ट्रैंड से इलेक्ट्रॉनिक तीर के रूप में जाने जाते हैं) से जुड़े होते हैं।
एक सहसंयोजक लिंक स्थापित करने की योजना को एक बिंदु के साथ इलेक्ट्रॉनिक रिंग की गैर-जोड़ी और दो बिंदुओं के साथ इलेक्ट्रॉनिक लिंक के माध्यम से प्रकट किया जा सकता है। स्पिल्नु इलेक्ट्रॉनिक कपल, टोबटो। सहसंयोजक कड़ी, अक्सर चावल से जुड़ी होती है। प्रारंभिक इलेक्ट्रॉनिक जोड़ी पानी में परमाणुओं के s-कक्षीय के मुड़ने के परिणामस्वरूप स्थापित होती है, जबकि कक्षीय के मुड़ने के क्षेत्र में, इलेक्ट्रॉनिक गस्टिन स्थानांतरित हो जाता है।
क्लोरीन Cl2 अणु में एक सहसंयोजक कड़ी की स्थापना स्पष्ट रूप से दिखाई देती है। क्लोरीन परमाणुओं का एक इलेक्ट्रॉनिक सूत्र हो सकता है: 17Cl 1s2 2s2 2p6 3s2 3p5।
क्लोरीन परमाणु सबसे ऊर्जावान स्तर पर पाया जा सकता है, और 3p पर - आमतौर पर इलेक्ट्रॉनों का एक गैर-युग्मन होता है। जब क्लोरीन के दो परमाणु करीब होते हैं, तो अयुग्मित इलेक्ट्रॉनों के साथ 3p - कक्षाओं का एक क्रॉस प्रदर्शित होता है और एक विदेशी इलेक्ट्रॉनिक दांव स्थापित होता है। Cl2 अणु में त्वचा क्लोरीन परमाणु में तीन गैर-विनाशकारी इलेक्ट्रॉनिक दांव होते हैं (जो एक परमाणु पर होते हैं)।
पानी के अणु H2, साथ ही क्लोरीन Cl2 के अणुओं में एक सरल (एकल) लिंक होता है। अणु, जिसमें दो परमाणु होते हैं, दो तीन इलेक्ट्रॉनिक दांव होते हैं। इस तरह के सहसंयोजक लिंक को, जाहिरा तौर पर, अधीनस्थ और अधीनस्थ कहा जाता है। उप-और द्वितीयक लिंक का प्रारंभिक नाम एकाधिक लिंक है।
उदाहरण के लिए, यह स्पष्ट है कि O2 अणु में सहसंयोजक लिंक स्पष्ट रूप से स्थापित है। परमाणु मैं इलेक्ट्रॉनिक सूत्र लिख सकता हूं: 8 ओ 1s2 2s2 2p4।
परमाणु, सबसे ऊर्जावान स्तर पर बहुत सारे इलेक्ट्रॉन होते हैं, और 2p पर दो अयुग्मित इलेक्ट्रॉन होते हैं। O2 अणु में स्थापित रासायनिक कड़ी में, त्वचीय परमाणुओं के दो इलेक्ट्रॉन भाग लेते हैं। वहीं, दो इलेक्ट्रॉनिक बेट्स (सब-लिंक) हैं। पतला परमाणु O2 अणु में खट्टा होता है।
जब एक विदेशी इलेक्ट्रॉनिक शर्त की स्थापना के लिए एक एकल दो-इलेक्ट्रॉन विन्यास में परमाणुओं के साथ त्वचा के अणु में एक सहसंयोजक लिंक स्थापित किया जाता है। बाद के मामलों में, जब एक सहसंयोजक लिंक स्थापित होता है, उदाहरण के लिए, परमाणुओं से क्लोरीन और त्वचा के अणु - एक साधारण विन्यास, आठ इलेक्ट्रॉनों में संग्रहीत किया जा सकता है।
प्रत्येक तीन अलग-अलग अणुओं (पानी, क्लोरीन और एसिड) में, समान विद्युतीयता वाले परमाणुओं के बीच सहसंयोजक लिंक स्थापित होता है। शिक्षा के दौरान इस तरह की बातचीत को बढ़ावा दिया जाता है सरल शब्द-अधातुअणु जो दो समान परमाणुओं से बने होते हैं, और यहां इलेक्ट्रॉनिक दांव परमाणुओं के नाभिक के बीच सममित रूप से व्यवस्थित होते हैं, बनने के लिए। इसके अलावा, अणु स्थापित हो जाते हैं, जिस पर सकारात्मक और नकारात्मक चार्ज के केंद्र बढ़ने लगते हैं।
ओत्ज़े, सहसंयोजक लिंक, जो गैर-ध्रुवीय इलेक्ट्रॉनिक जोड़े के राखुनोक के लिए समान विद्युतीयता वाले परमाणुओं के बीच होने का दिखावा करता है, एक सहसंयोजक गैर-ध्रुवीय लिंक कहलाता है। याद रखना आवश्यक है, इस प्रकार की रासायनिक ध्वनि साधारण अधातुओं में स्थापित होती है। याक ने फ्लोरीन को एक सहसंयोजक गैर-ध्रुवीय प्रकार के साथ बट दिया, लिंक को फ्लोरीन F2, ब्रोमीन Br2, आयोडीन I2, नाइट्रोजन N2 कहा जा सकता है।
चूंकि परमाणु, इंटरकनेक्शन के परिणामस्वरूप, विद्युत रूप से नकारात्मक (अन्य रासायनिक तत्वों के परमाणु) नहीं हो सकते हैं, तो आउट-ऑफ-द-बॉक्स इलेक्ट्रॉनिक जोड़ी अधिक इलेक्ट्रोनगेटिविटी वाले परमाणु में बदल जाती है। उसी समय, परमाणु पर अधिक विद्युतीयता के साथ एक भिन्नात्मक ऋणात्मक आवेश बनता है, और कम विद्युतीयता वाले परमाणु पर एक भिन्नात्मक धनात्मक आवेश बनता है। निरपेक्ष मूल्यों के लिए विशेष शुल्क एक से कम हैं।
उदाहरण के लिए, जब अणु को एचसीएल क्लोराइड में स्थापित किया जाता है, तो परमाणु के s-कक्षक का क्रॉस सेक्शन क्लोरीन परमाणु के p-कक्षक में जोड़ा जाता है। प्रारंभिक इलेक्ट्रॉनिक जोड़ी परमाणुओं के केंद्रों के बीच असममित रूप से घूमती है, जो परस्पर संगत हैं। वोना अधिक इलेक्ट्रो-नकारात्मक क्लोरीन की जगह लेता है।
क्लोरीन परमाणु पर आंशिक ऋणात्मक आवेश बनता है और जल परमाणु में आंशिक धनात्मक आवेश बनता है। और यहाँ धनात्मक और ऋणात्मक आवेशों के केंद्र के अणु नष्ट नहीं होते हैं। इन अणुओं को ध्रुवीय या द्विध्रुव कहा जाता है। द्विध्रुव दो आवेशों की एक प्रणाली है, जो मान के बाद समान होते हैं, और चिह्न के बाद थोड़े विपरीत होते हैं।
साथ ही, सहसंयोजक कड़ी, जो परमाणुओं के बीच स्थापित होती है, जिसकी विद्युत् ऋणात्मकता थोड़ी भी होती है, सहसंयोजक ध्रुवीय कड़ी कहलाती है। याद रखना आवश्यक है, इस प्रकार की रासायनिक ध्वनि को फोल्डिंग स्पीच में स्थापित किया जाना चाहिए, जिसे गैर-धातुओं के परमाणुओं द्वारा अनुमोदित किया जाता है। याक बट फ्लोराइड एचएफ, पानी एच 2 ओ, अमोनिया एनएच 3, मीथेन सीएच 4, कार्बन (चतुर्थ) ऑक्साइड सीओ 2।
एक सहसंयोजक प्रकार के रासायनिक लिंक वाले अणु के लिए, एक इलेक्ट्रॉनिक संरचनात्मक (ग्राफ) सूत्र लिखा जा सकता है। इलेक्ट्रॉनिक सूत्र रासायनिक तत्वों के प्रतीकों पर आधारित है, इलेक्ट्रॉनिक दांव के पदनाम के बिंदुओं के पास, और परमाणुओं के बीच - इलेक्ट्रॉनिक दांव। संरचनात्मक (ग्राफ) सूत्र एक त्से सूत्र है, डी-स्किनी इलेक्ट्रॉनिक जोड़ी को चावल द्वारा दर्शाया जाता है। याक इलेक्ट्रॉनिक, और संरचनात्मक सूत्र अणुओं और उनके बंधनों में परमाणुओं के क्रम को दर्शाते हैं।
सहसंयोजक कड़ी। ध्रुवीय और गैर-ध्रुवीय सहसंयोजक लिंक
सहसंयोजक कॉल- लिंक की एक श्रृंखला, जहां दूरस्थ इलेक्ट्रॉनिक जोड़े (उदाहरण के लिए, एच 2, एचसीएल, एच 2 ओ, ओ 2) की स्थापना के लिए परमाणु होते हैं।
दूरस्थ इलेक्ट्रॉनिक जोड़े को उनके द्वारा जुड़े परमाणुओं में से एक में बदलने के कदम के पीछे, सहसंयोजक लिंक ध्रुवीय या गैर-ध्रुवीय हो सकता है।
ए) सहसंयोजक गैर-ध्रुवीय कॉल (सीएनएस)- एक ही के परमाणु बनाओ खुशमिजाज तत्व- अधातु (उदाहरण के लिए, H2, O2, O3)।
संचार का तंत्र।
एक इलेक्ट्रॉनिक जोड़ी के पीछे के कमरे में एक अधातु के लिए एक चमड़े का परमाणु दिखाया गया है। इलेक्ट्रॉनिक दांव लगाए जाते हैं। इलेक्ट्रॉनिक जोड़ी परमाणुओं के समान है।
क्लोरीन अणु के घोल का तंत्र स्पष्ट है:
Cl2 अणु पुष्टिकरण की इलेक्ट्रॉनिक योजना:
Cl2 अणु का संरचनात्मक सूत्र:
σ
सीएल - सीएल, (पी - पी) - सिंगल लिंक

अणु की स्थापना का तंत्र स्पष्ट है:
O2 - एनएस।
O2 अणु अनुमोदन की इलेक्ट्रॉनिक योजना:
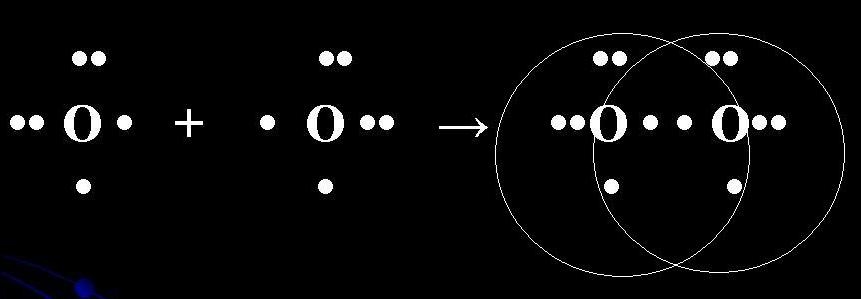
O2 अणु का संरचनात्मक सूत्र:
σ
ओ = ओ
π
अणु में एक बहु, उप-लिंक होता है:
एक (पी - पी)

वह एक π (पी - पी)
बी) सहसंयोजक ध्रुवीय बैंड (सीपीएस)- अन्य गैर-धातुओं के परमाणुओं की पुष्टि करें, जो विद्युत नकारात्मकता (उदाहरण के लिए, एचसीएल, एच 2 ओ) के मूल्यों पर आधारित हैं।
यदि सहसंयोजक कड़ी एक परमाणु को एक अधातु और एक धातु से स्थिर करती है तो शब्दचित्र हैं!
उदाहरण के लिए, AlCl3, वैद्युतीयऋणात्मकता में अंतर E.O.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
इलेक्ट्रोनगेटिविटी (ईओ) - एक तत्व के परमाणुओं की शक्ति दूसरे तत्वों के परमाणुओं से इलेक्ट्रॉनों को अपनी ओर आकर्षित करती है। Nybilsh विद्युत ऋणात्मक तत्व - फ्लोरीन F.
विद्युत ऋणात्मकता विभिन्न तरीकों से और प्रत्येक वृद्धि के लिए तत्वों को एक पंक्ति में लाकर परिलक्षित हो सकती है। अक्सर अमेरिकी रसायनज्ञ एल. पॉलिंग के प्रस्तावना कई विद्युत ऋणात्मक तत्व विजयी होते हैं।
टेबल। डेयाकी तत्वों की इलेक्ट्रोनगेटिविटी (ईओ) (ईओ विकास के लिए क्रम में रखी गई)।

संचार का तंत्र।
एक गैर-धातु के लिए एक चमड़े का परमाणु घर के पीछे उसके नाम पर दिखाया जाता है, न कि किसी इलेक्ट्रॉनिक उपकरण को जोड़ने के लिए। इलेक्ट्रॉनिक दांव लगाए जाते हैं। प्रारंभिक इलेक्ट्रॉनिक जोड़ी विद्युत रूप से नकारात्मक तत्व में कम हो जाती है।
क्लोरीन-पानी के अणु के घोल का तंत्र स्पष्ट है:
Cl - केपीएस।
एचसीएल अणु पुष्टिकरण की इलेक्ट्रॉनिक योजना:

यह किसी के लिए भी रहस्य नहीं है कि रसायन विज्ञान - विज्ञान काफी स्मार्ट है और उससे पहले, बहुमुखी है। बिना रुके प्रतिक्रियाओं, अभिकर्मकों, रसायन विज्ञान और तह और अनुचित शब्दों के बिना - सभी बदबू एक-एक करके संयुक्त होते हैं। एले स्मज, मैं आज खुश होने जा रहा हूं, यह सम्मानजनक नहीं है, जो हमारे पाठकों द्वारा उस समय और अपनी नई सामग्री के साथ सुना जाएगा, या मैं चाय पीऊंगा, जो एक खुशहाल प्रक्रिया हो सकती है।
आप visnovok, scho . बदल सकते हैं बड़प्पन की रसायन शास्त्र बस जरूरी हैहमारे प्रकाश के नियम के साथ-साथ इस भाग के परिवेश के रूप में नए और बड़प्पन में प्रवेश करें - tsikavo, और, इसके अलावा, दालचीनी।
एक सहसंयोजक कड़ी के रूप में ऐसे शब्द के साथ संबंध विकसित करने के लिए हमारे लिए संक्रामक, जो भाषण से पहले ध्रुवीय या गैर-ध्रुवीय हो सकता है। भाषण से पहले, शब्द "सहसंयोजक", लैटिन "सह" में होने का दिखावा करता है - एक बार में और "वेल्स" - मेरे पास शक्ति है।
दिखने वाला शब्द
किसी कारण से, अपने लिए शब्द "सहसंयोजक" पहली बार 1919 में इरविंग लैंगमुइर रोटसी में आया था।नोबेल पुरस्कार विजेता। एक रासायनिक रिंग के "सहसंयोजक" संचरण को समझना, एक परमाणु के लिए अपराध के मामले में, एक विद्युत दोष हो सकता है, इसे एक स्पिनी वोलोडिन्यम कहा जाता है। इस तरह के रैंक में, उदाहरण के लिए, आपको धातु के रूप में नहीं देखा जाएगा, किसी भी प्रकार की विद्युत शक्ति में, या, उदाहरण के लिए, एक प्रकार की शक्ति में। स्लाइड का अर्थ है कि आप अधातुओं के मिश्रण में आ जाते हैं।
Vyhodyachy vyshekazanogo, उन लोगों के बारे में एक छोटा सा विस्नोवोक बनाना संभव है, जो स्वयं एक प्रक्रिया है। राखुनोक के परमाणुओं के बीच वोना की जीत आउट-ऑफ-द-बॉक्स इलेक्ट्रॉनिक जोड़े को मंजूरी देती है, इसके अलावा, वे इलेक्ट्रॉनों के कॉल और कॉल सिग्नल पर जीतते हैं।
इसे रखो, ध्रुवीय से शब्द:
सहसंयोजक लिंक देखें
इसके अलावा, दो प्रकार हैं - संपूर्ण ध्रुवीय, और, जाहिरा तौर पर, गैर-ध्रुवीय संबंध। त्वचा के विशेष गुण ठीक होते हैं।
सहसंयोजक ध्रुवीय - osvita
"ध्रुवीय" शब्द क्या है?
 इसे इस तरह नाम दें, ताकि दो परमाणु विद्युत ऋणात्मकता से भिन्न हो सकें, उसी से, आउट-ऑफ-द-बॉक्स इलेक्ट्रॉनिक्स एक ही तरह से संबंधित नहीं हैं, लेकिन बदबू एक के करीब पाई जाती है, आखिरी तक नहीं। उदाहरण के लिए, क्लोरीन पानी का एक अणु, सहसंयोजक लिंक के इलेक्ट्रॉनों के मामले में, क्लोरीन के परमाणु के करीब बढ़ता है, भोजन में इसकी विद्युतीयता का एक अंश, पानी में कम। हालांकि, वास्तव में, भारी इलेक्ट्रॉनों में अंतर बड़ा नहीं है, इलेक्ट्रॉन को क्लोरीन में स्थानांतरित करने में जितना समय लगता है।
इसे इस तरह नाम दें, ताकि दो परमाणु विद्युत ऋणात्मकता से भिन्न हो सकें, उसी से, आउट-ऑफ-द-बॉक्स इलेक्ट्रॉनिक्स एक ही तरह से संबंधित नहीं हैं, लेकिन बदबू एक के करीब पाई जाती है, आखिरी तक नहीं। उदाहरण के लिए, क्लोरीन पानी का एक अणु, सहसंयोजक लिंक के इलेक्ट्रॉनों के मामले में, क्लोरीन के परमाणु के करीब बढ़ता है, भोजन में इसकी विद्युतीयता का एक अंश, पानी में कम। हालांकि, वास्तव में, भारी इलेक्ट्रॉनों में अंतर बड़ा नहीं है, इलेक्ट्रॉन को क्लोरीन में स्थानांतरित करने में जितना समय लगता है।
ध्रुवता के माध्यम से, विद्युत शक्ति को एक बड़े इलेक्ट्रोनगेटिव में बदल दिया जाता है, नई वाइन में आंशिक नकारात्मक चार्ज होता है। अपने स्वयं के हृदय में, उस नाभिक पर, जिसकी विद्युत ऋणात्मकता कम होती है, स्पष्ट रूप से आंशिक धनात्मक आवेश होता है।
रोबिमो विस्नोवोक:छोटे गैर-धातुओं के साथ ध्रुवीय विनिक, जो विद्युतीयता के मूल्यों पर आधारित होते हैं, और इलेक्ट्रॉन अधिक विद्युतीयता के साथ कोर के करीब बढ़ते हैं।
इलेक्ट्रोनगेटिविटी - कुछ परमाणुओं की क्षमता खुद को इलेक्ट्रॉनों को आकर्षित करने के लिए, स्वयं एक रासायनिक प्रतिक्रिया बनाकर।
सहसंयोजक ध्रुवता लागू करें, सहसंयोजक ध्रुवीय लिंक के साथ भाषण:
सहसंयोजक ध्रुवीय लिंक के साथ रेसीओविनी का सूत्र
सहसंयोजक गैर-ध्रुवीय, ध्रुवीय और गैर-ध्रुवीय के बीच अंतर
मैं नरेश्टी, गैर-ध्रुवीय, जल्द ही हम इसके बारे में जागरूक होंगे।
ध्रुवीय से गैर-ध्रुवीय का मुख्य दृश्य- त्से समरूपता। यदि इलेक्ट्रॉनों की ध्रुवता एक परमाणु के करीब बढ़ जाती है, तो गैर-ध्रुवीय वलय के साथ, इलेक्ट्रॉन सममित रूप से फड़फड़ाते हैं, ताकि एक ही दुनिया में यह दोनों तक खराब हो जाए।
उल्लेखनीय है कि अध्रुवीयता एक रासायनिक तत्व के परमाणुओं और अधातु के बीच होती है।
उदाहरण के लिए, गैर-ध्रुवीय सहसंयोजक लिंक के साथ भाषण:
इसके अलावा, इलेक्ट्रॉनिक्स की सर्वोच्चता को अक्सर इलेक्ट्रॉनिक बकवास के रूप में संदर्भित किया जाता है, जो मजबूत होता है, लेकिन एक इलेक्ट्रॉनिक सुराग, जैसे इलेक्ट्रॉनिक्स की एक जोड़ी स्थापित होती है, सामान्य रूप से सममित रूप से या समान रूप से अंतरिक्ष में वितरित की जाती है।
एक सहसंयोजक गैर-ध्रुवीय लिंक लागू करें जो एक सहसंयोजक गैर-ध्रुवीय लिंक स्थापित करने की योजना है
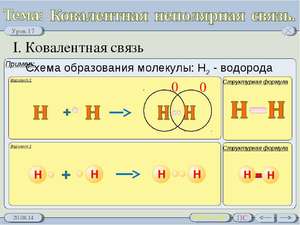
सहसंयोजक ध्रुवीय और गैर-ध्रुवीय के विकास के रूप में, एले भी एक महान कुलीन है।
सहसंयोजक गैर-ध्रुवीय- एक ही प्रकार के भाषण के परमाणु का सिर। एच2. सीएल2.
लेख के अंत में अंत जोड़ा गया, अब यह ज्ञात है कि यह एक रसायन प्रक्रिया है, इसके अलावा इस और उस तरह के सपने की शुरुआत के अलावा, भाषणों को अपनाने के सूत्र, और सभी में हमारे तह प्रकाश के बारे में तीन और, इस नए रूप में सफलता।
एक प्रकार की जयजयकार ध्वनि
सहसंयोजक: गैर-ध्रुवीय, ध्रुवीय, दाता-स्वीकर्ता।
इओना
मेटालेवा
वोडनेवा
सहसंयोजक कड़ी
सहसंयोजक लिंक (परमाणु लिंक, होमोपोलर लिंक) एक चुटीली कड़ी है, वैलेंस इलेक्ट्रॉनिक हम्स के रीरिट (उजागलन्याम) दांव के लिए बयान। इलेक्ट्रॉनिक खमारी (इलेक्ट्रॉनिक), scho zabechuyut zyazyazyutsya, को इनबाउंड इलेक्ट्रॉनिक जोड़ी कहा जाता है।
एक साधारण सहसंयोजक लिंक दो अयुग्मित संयोजकता इलेक्ट्रॉनों के साथ स्थापित होता है, एक के लिए
त्वचा परमाणु से:
ए + बी → ए: बी
विद्युत प्रणाली में सुधार के परिणामस्वरूप, ऊर्जा आपूर्ति निर्धारित की जाती है। कनेक्शन स्थापित किया जाएगा, क्योंकि यह पूरे समय के लिए ऊर्जा की कुल मात्रा है, कोब मिल में नहीं (और ऊर्जा में अंतर इसमें से कोई नहीं होगा, क्योंकि यह एक ऊर्जा कनेक्शन है)।
सहसंयोजक गैर-ध्रुवीय (गैर-धातु-गैर-धातु)
जिस तरह परमाणु, जो एक साधारण सहसंयोजक लिंक स्थापित कर सकते हैं, हालांकि, अणुओं में परमाणुओं के संदर्भ शुल्क भी समान होते हैं, परमाणुओं के टुकड़े, जो एक लिंक स्थापित कर सकते हैं, हालांकि, एक इलेक्ट्रॉनिक जोड़ी को अनदेखा कर सकते हैं। इस तरह की कड़ी को गैर-ध्रुवीय सहसंयोजक लिंक कहा जाता है। ऐसा वलय सरल शब्द हो सकता है, उदाहरण के लिए O2, N2, Cl2। एले न केवल एक ही प्रकार के गैर-धातुओं का उपयोग सहसंयोजक गैर-ध्रुवीय लिंक बनाने के लिए किया जा सकता है। एक सहसंयोजक गैर-ध्रुवीय लिंक का उपयोग गैर-धातु तत्वों के लिए भी किया जा सकता है, कुछ मूल्यों की विद्युतीयता, उदाहरण के लिए, PH3 अणुओं में सहसंयोजक गैर-ध्रुवीय , Oskіlki EO vodnyu Dorіvnyu EO फॉस्फोरस।
सहसंयोजक ध्रुवीय (ईओₐ ईओₓ)
जैसे-जैसे परमाणु विकसित होते हैं, तो कुछ इलेक्ट्रॉनों के साथ वोलोडिन के चरण परमाणुओं की विद्युत-ऋणात्मकता में अंतर के साथ शुरू होंगे। अधिक विद्युत ऋणात्मकता वाला परमाणु अधिक मजबूती से कुछ इलेक्ट्रॉनों को अपनी ओर आकर्षित करेगा, और दूसरा आवेश ऋणात्मक हो जाएगा। प्रफुल्लित की कम विद्युतीयता वाला परमाणु, जाहिरा तौर पर, परिमाण के पीछे ऐसा सकारात्मक चार्ज। यदि यह तथ्य की बात है, यह दो अलग-अलग अधातुओं की बात है, तो इसे कहते हैं सहसंयोजक ध्रुवीय लिंक .
दाता स्वीकर्ता
दाता-स्वीकर्ता तंत्र (समन्वय का तंत्र) दो परमाणुओं, या परमाणुओं के समूह के बीच एक सहसंयोजक रासायनिक लिंक स्थापित करने की एक विधि है, ताकि आप इलेक्ट्रॉनिक दाता परमाणु और एक श्रृंखला की एक अस्वीकृत जोड़ी में शामिल हो सकें।
शब्द "दाता-स्वीकर्ता लिंक" या "समन्वय लिंक" सही नहीं है, लेकिन यह केवल एक प्रकार की चुटीली ध्वनि नहीं है, बल्कि एक सैद्धांतिक मॉडल है जो गोद लेने की ख़ासियत का वर्णन करता है। दाता-स्वीकर्ता तंत्र के लिए स्थापित सहसंयोजक रासायनिक लिंक की शक्ति, लिंक की शक्ति से प्रकट नहीं होती है, जो सामान्य तंत्र के लिए स्थापित होती है (उदाहरण के लिए, लिंक एन-एच-एच-ओएच 3)।
आधे समय में जटिल अकार्बनिक धनायन में एक मोनोवैलेंट धातु की भूमिका होती है। रासायनिक सूत्र NH4+ है। एसिड की श्रेणी में अमीक का पता लगाने पर, निम्नलिखित प्रतिक्रिया होती है:
NH3 + H + = NH4 +
^
हाइड्रॉक्सोनियम (ऑक्सोनियम, हाइड्रॉक्सोनियम) + एक जटिल आयन है, जो पानी के एक अणु में एक प्रोटॉन का स्थानांतरण करता है।
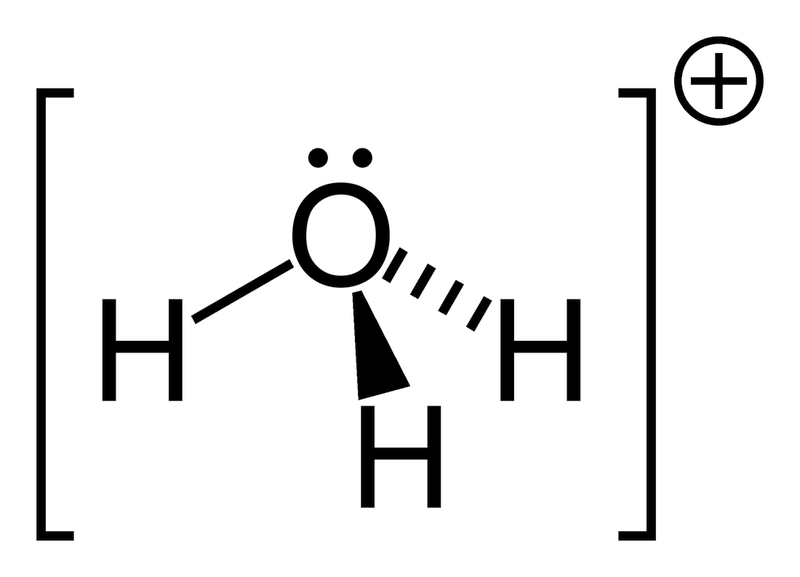
दाता नाइट्रोजन, एसिड, फास्फोरस, सिरकी और अन्य को परमाणु दान करने के लिए दान करते हैं। स्वीकर्ता की भूमिका पानी एच + के साथ परमाणु का आयनीकरण हो सकता है, पी-मेटल का कार्य (उदाहरण के लिए, आयन अलएच 4- के अनुमोदन के साथ एल्यूमीनियम), और विशेष रूप से डी-तत्व, जो ऊर्जा नहीं जोड़ सकता है वैलेंस इलेक्ट्रॉनिक के लिए।
दाता-स्वीकर्ता तंत्र की स्थिति जटिल (समन्वय) संबंधों के अणुओं और आणविक आयनों में स्थानीयकृत सहसंयोजक लिंक की स्थापना का वर्णन करती है: विद्युत या इलेक्ट्रॉनिक परिसर की एक गैर-पृथक जोड़ी के लिए लिंक बनते हैं दाता-स्वीकर्ता तंत्र मध्यवर्ती उत्पादों (इंटरमीडिया) प्रतिक्रियाओं की स्थापना के लिए भी जिम्मेदार है, उदाहरण के लिए, स्थानांतरित प्रभार वाले परिसरों।
दाता-स्वीकर्ता तंत्र का मॉडल केवल इलेक्ट्रॉनिक शक्ति की वैधता और स्थानीयकरण की घटना के ढांचे के भीतर है जब सहसंयोजक लिंक स्थापित होते हैं (वैलेंस योजनाओं की विधि)। आणविक कक्षीय विधि की सीमाओं पर, अन्य अभिव्यक्तियों से इसका उपभोग करना आवश्यक नहीं है।
^
द्वितीय. आयनी रिंग (धातु-गैर-धातु)
आयनी लिंक एक ठंडा रासायनिक वलय है, जिसे परमाणुओं के बीच बड़ी वृद्धि के साथ स्थापित किया जा सकता है ( >1,7
पॉलिंग स्केल पर) इलेक्ट्रोनगेटिविटी, जब एक इलेक्ट्रॉनिक जोड़ी होती है, तो मैं अक्सर अधिक इलेक्ट्रोनगेटिविटी के साथ परमाणु में जाऊंगा। बहुत सारी ऊर्जा की कीमत अलग है। बट के साथ, आप CsF का उपयोग कर सकते हैं, जिसके लिए "आयनिक के चरण" 97% हो जाते हैं। यह स्पष्ट है कि सोडियम क्लोराइड NaCl के साथ बट को कैसे रोशन किया जाए। सोडियम और क्लोरीन परमाणुओं का इलेक्ट्रॉनिक विन्यास निर्धारित किया जा सकता है: 11 ना 1s2 2s2 2p 6 3s1; 17 क्ल 1एस2 2एस2 2पी6 एस2 3р5
याक त्से परमाणु अधूरी ऊर्जा दौड़ है। जाहिर है, सोडियम परमाणु का अंतिम समापन एक इलेक्ट्रॉन प्राप्त करना आसान है, न कि आना, और क्लोरीन परमाणु के लिए एक इलेक्ट्रॉन प्राप्त करना आसान है, न कि आना। बातचीत के साथ, सोडियम परमाणु बढ़कर एक इलेक्ट्रॉन हो जाएगा, और क्लोरीन परमाणु ले लिया जाएगा। योजनाबद्ध रूप से, कीमत इस प्रकार लिखी जा सकती है: नाº - एल ई -> ना +एक और ऊर्जावान rіvnya के राखुनोक के लिए सोडियम, stіyka आठ-इलेक्ट्रॉन 1s2 2s2 2p6 खोल।
Clº + 1е → Cl¯- आयन से क्लोरीन, आठ-इलेक्ट्रॉन खोल का ढेर। आयनों Na + और Cl- के बीच, एक इलेक्ट्रोस्टैटिक बोझ होता है, और परिणाम स्थापित होता है। आयनी लिंक सहसंयोजक ध्रुवीय लिंक का चरम प्रकार का ध्रुवीकरण है। ठेठ धातु और अधातु के बीच पुष्टि की गई।
इलेक्ट्रॉनिक्स की एक विस्तृत श्रृंखला के साथ, धातु गैर-धातु से अधिक हो जाएगी। पुष्टिकरण भाग का प्रभार है।
यदि परमाणुओं के बीच रासायनिक लिंक को अपनाया जाता है, तो विद्युत नकारात्मकता में और भी अधिक वृद्धि होती है (ईओ> 1.7 पोलिंग के लिए। इसके परिणामस्वरूप अन्य आयनों को चार्ज करने की प्रक्रिया की पुष्टि:
Mіzh Ions, scho सेटलमेंट, जीत इलेक्ट्रोस्टैटिक रूप से कठिन है, क्योंकि इसे इननी साउंड कहा जाता है। अधिक सटीक रूप से, ऐसा लुक। वास्तव में, शुद्ध दृष्टि से परमाणुओं के बीच संबंध को कहीं भी या कहीं भी महसूस नहीं किया जा सकता है, क्योंकि कनेक्शन भिन्नात्मक और सहसंयोजक प्रकृति के होते हैं। उसी समय, तह आणविक आयनों की कड़ियों को अक्सर विशुद्ध रूप से आयनिक बनाया जा सकता है। दूसरी ओर, गैर-दिशात्मकता और असंतृप्ति के मामले में, अन्य प्रकार के रासायनिक कनेक्शन के साथ आयनिक कनेक्शन के पहलू में अंतर होता है। आयनिक ध्वनि की ध्वनि के लिए स्वीकृत वही क्रिस्टल पिछले वाले की नई पैकेजिंग तक भारी हैं।
ऐसे स्पोलुक्स की विशेषता यह है कि उनके पास ध्रुवीय रेज़चिनिक (पानी, एसिड और पतला) में अच्छा रैज़चिनिस्ट होता है। कीमत अणु के तत्वों के प्रभार के माध्यम से स्थानांतरित की जाती है। वितरक के बहुत सारे द्विध्रुवों के साथ, वे अणु के आवेशित छोर की ओर आकर्षित होंगे, और ब्राउनियन रफ़ के परिणामस्वरूप, भाषण के अणु को एक ऐसे हिस्से में "खिंचाव" करेंगे जो इसे महसूस किए बिना, ज्ञान दिए बिना महसूस करेंगे फिर व। परिणाम उन्हें वितरक के द्विध्रुव द्वारा बंद कर देंगे। 
^ धातु की अंगूठी
धातु की अंगूठी एक खुशमिजाज अंगूठी है, जो इलेक्ट्रॉनिक उपकरणों की एक विस्तृत श्रृंखला की उपस्थिति में ज़ूम करती है। याक शुद्ध धातुओं के साथ-साथ मिश्र धातुओं और इंटरमेटेलिक स्पोलुक के लिए भी विशेषता है।
धातु लिंक का तंत्र
क्रिस्टलीय क्रेट के सभी विश्वविद्यालयों में, धातु के प्रति उनका सकारात्मक दृष्टिकोण है। उनके बीच, इलेक्ट्रॉनों की संयोजकता गैस के अणुओं की तरह ढह जाती है, जब आयनों के स्वीकृत होने पर परमाणु दिखाई देते हैं। त्से इलेक्ट्रोनी सीमेंट की भूमिका निभाते हैं, एक बार सकारात्मक रूप से संतृप्त होते हैं; सबसे पहले, भीड़ से बड़ी मात्रा में ऊर्जा के साथ मुफ्त गिर गया। इसी समय, विद्युत प्रणाली क्रिस्टलीय क्रेटों की सीमाओं में आयनों से भर जाती है और इसे छोड़ा नहीं जा सकता है। यदि कॉल स्थानीयकृत नहीं थी और स्थानीयकृत नहीं थी। उसके लिए, उच्च समन्वय संख्याएँ हैं (उदाहरण के लिए, 12 बजे और 8)।
परमाणुओं की एक पैकिंग के साथ आगे बढ़ने वाले लीपोसिमेट्रिक क्रेट्स में से एक के लिए बड़ी संख्या में धातुओं का उपयोग किया जा सकता है:
क्यूबिक वॉल्यूमेट्रिक केंद्रित, क्यूबिक फेस-केंद्रित और हेक्सागोनल।
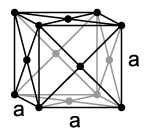
क्यूबिक वॉल्यूम सेंटेड ग्रेट्स (बीसीसी) में, परमाणु क्यूब के कोने पर और क्यूब के केंद्र में एक परमाणु रोस्टेड होते हैं। क्यूबिक वॉल्यूम केंद्रित ग्रेट्स धातु हो सकते हैं: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba और IN।

क्यूबिक फेस-सेंटेड ग्रेट्स (FCC) में, क्यूब के शीर्ष पर और त्वचा के चेहरे के केंद्र में परमाणुओं को रोस्टेड किया जाता है। इस प्रकार की धातु को घिसें: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co और IN।
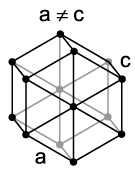
हेक्सागोनल ग्रिड में, परमाणुओं को प्रिज्म के साथ हेक्सागोनल बेस के शीर्ष और केंद्रों पर और तीन परमाणुओं को मध्य क्षेत्र में प्रिज्म के साथ रोसेट किया जाता है। परमाणुओं की ऐसी पैकिंग धातु हो सकती है: Mg, -Ti, Cd, Re, Os, Ru, Zn, -Co, Be, -Ca और IN।
शक्ति
Electroni, scho volno ढहने के लिए, उच्च शक्ति और तापीय चालकता में जोड़ें। भाषण, जो धात्विक संबंधों का कारण बन सकते हैं, अक्सर प्लास्टिसिटी की शक्ति को जोड़ते हैं, क्योंकि जब परमाणु बदलते हैं, तो एक और दूसरे को संबंधों का टूटना नहीं दिखाई देता है।
^
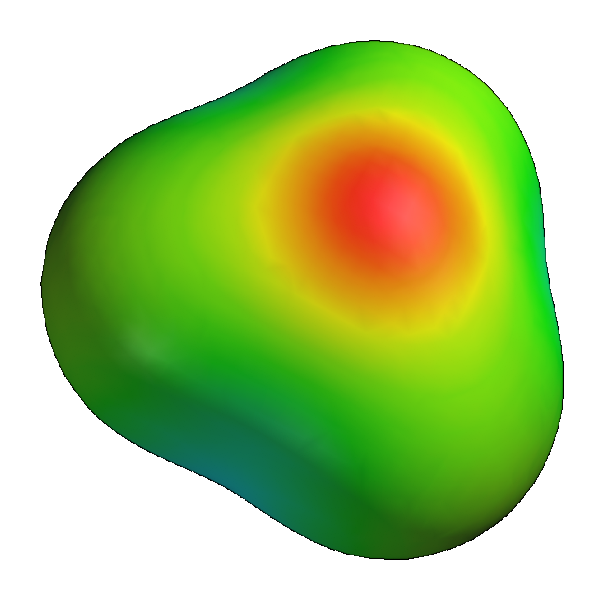
चतुर्थ। पानी वाली अंगूठी
पानी वाली अंगूठी- एक इलेक्ट्रोनगेटिव परमाणु और पानी एच के एक परमाणु के बीच संबंध का रूप, एक इलेक्ट्रोनगेटिव परमाणु के साथ सहसंयोजक रूप से बंधा हुआ। या तो इलेक्ट्रोनगेटिव परमाणु एन, ओ या एफ हो सकते हैं। पानी के बंधन इंटरमॉलिक्युलर या इंट्रामोल्युलर हो सकते हैं।
अक्सर, एक पानी की अंगूठी एक इलेक्ट्रोस्टैटिक इंटरैक्शन की तरह दिखती है, जो पानी की एक छोटी मात्रा द्वारा समर्थित होती है, जो एक दूसरे से जुड़े द्विध्रुव की निकटता की अनुमति देती है। यानी एक प्रकार के दाता-स्वीकर्ता लिंक के बारे में, जो एच परमाणु के बीच गैर-संयोजक है, और सहसंयोजक रूप से ए परमाणु से जुड़ा हुआ है ग्रुपी ए-एचअणु आरए-एच और अणु के विद्युत नकारात्मक परमाणु बी (या एक ही अणु का एक कार्यात्मक समूह) बीआर "। इस तरह की बातचीत का परिणाम आरए-एच बीआर" स्थिरता की एक अलग डिग्री का परिसर है, जिसमें परमाणु दिखाई देते हैं एक "पुल" टुकड़े के रूप में आरए और बीआर "।
पानी की आवाज़ की ख़ासियत, पीछे ओकेरेमी विग्लायड, इटसनस्ट की ऊंचाई से भी अधिक नहीं, व्यापकता और महत्व, विशेष रूप से जैविक क्षेत्रों में, साथ ही साथ क्रियाएं दुष्प्रभावछोटे आकार और पानी के पास पूरक इलेक्ट्रॉनों की एक विस्तृत विविधता के साथ क्रोकेटेड।
जलीय लिंक की ऊर्जा सहसंयोजक लिंक की ऊर्जा से काफी कम है (40 kJ / mol नहीं बदलती है)। दूसरी ओर, अणुओं के संघटन की जीत के लिए पर्याप्त ऊर्जा होती है, जिससे कि यह डिमेरी या पोलीमेरी में संयुक्त हो जाती है। अणुओं का जुड़ाव अपने आप में असामान्य है उच्च तापमानहाइड्रोजन फ्लोराइड, पानी, अमोनिया जैसी नदियों का पिघलना और पकाना।
प्रकार की एक कड़ी, जो एक और सहसंयोजक कड़ी के लिए कमजोर है, प्रोटिया, आंतरिक और अंतर-आणविक अंतःक्रियाओं में और भी महत्वपूर्ण भूमिका निभाती है। Vodnevі ध्वनियाँ क्या ज़ूम इन करने के लिए समृद्ध हैं शारीरिक शक्तिउस बैगाटोक कार्बनिक यौगिकों (अल्कोहल, कार्बोक्जिलिक एसिड, अमोनियम कार्बोक्जिलिक एसिड, फोल्डिंग ईथर) को चलाता है।
हवा में असामान्य रूप से पानी की गर्मी, और उच्च ग्रेड अल्कोहल की गर्मी चालकता, संख्यात्मक जल संबंधों से रोका जाएगा। पानी का एक अणु कुछ क्लासिक पानी से पानी के बंधन और निलंबन तक बनाया जा सकता है।
पानी के संबंध फोड़े के तापमान, चिपचिपाहट और सतह तनाव से छुटकारा दिलाते हैं। Vodnevі पानी की प्रचुर मात्रा में अद्वितीय शक्तियों के लिए idpovіdalі को जोड़ता है।
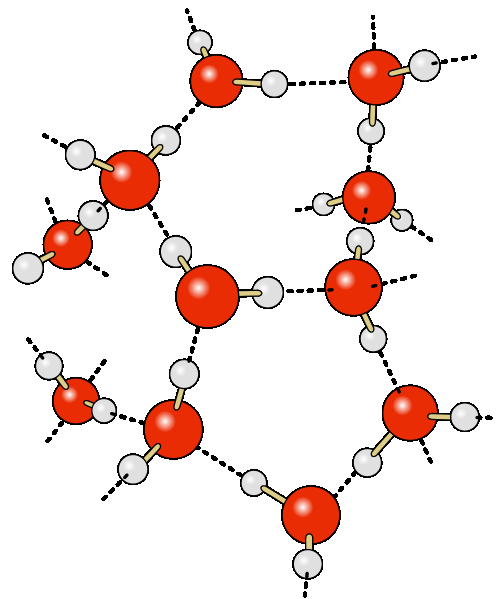
सामयिक साक्ष्य के कारण, पानी के अणुओं के बीच जल-आधारित कनेक्शन की उपस्थिति से जल-आधारित समूहों या परिसरों की उपस्थिति हो सकती है। ऐसे क्लस्टर का सबसे सरल बट डिमर ड्राइव हो सकता है:
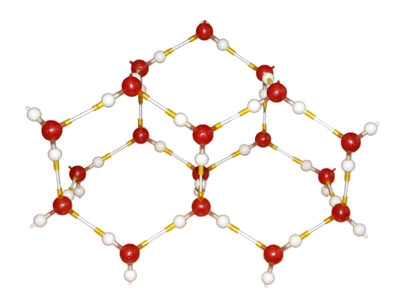
पानी H2O अणुओं की एक जाली द्वारा, पानी के संबंधों के साथ।

जब पानी जम जाता है, तो पानी बहुत आवाज करता है:
![]()
बर्फ के अणुओं में जल बंध:
कार्बनिक अम्लों के अणुओं के बीच जल बंधन:

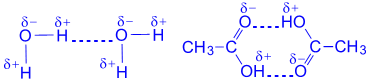
बैंकों में पानी की कॉल :

