Sam izraz "kovalentna veza" liči na dvije latinske riječi: "co" - spilno i "vales" - može biti jaka, jer je veza, da je zbog opklade elektrona, da treba da leži na jednom (inače se čini da je više neaktivan moj, veza između atoma za rahunok para elektrona, yakí ê spílnimi í̈m). Uspostavljanje kovalentne veze događa se isključivo među atomima nemetala, štoviše, može se pojaviti i u atomima molekula i u kristalima.
Prethodno je kovalentnu bulu daleke 1916. godine otkrio američki hemičar J. Lewis, i neko vrijeme se zasnivala na hipotezama, idejama, ali je tek tada bula eksperimentalno potvrđena. Šta su hemičari rekli o pogonu? A oni, Elektronigatovosty nemetala Buva, do velike, u isto vreme, na puki zajednicki krastavac, Elektroniv VID je jedan za ilkhoy moć, ali u trenutku, elektrovyvy, bili su Vinika vene.
tipi kovalentna veza
Zagalom - dvije vrste kovalentne veze:
- razmjena,
- prihvatanje donatora.
Sa razmjenskim tipom kovalentne veze između atoma kože od atoma, koji su povezani, predstavlja uspostavljanje elektronske veze preko jednog nesparenog elektrona. U isto vrijeme, elektroni su odgovorni za majčin protilezhní naboj (leđa).
Kraj slične kovalentne veze mogu biti oni koji su molekuli vode. Ako su atomi i voda blizu, tada elektronski mrak prodire jedan u drugi, nauka naziva preklapanje elektronske tame. Kao rezultat, povećava se gustina elektrona između jezgara, sami smradovi se privlače jedan prema jedan, a energija sistema se mijenja. Tim nije ništa manje, kada su jezgra blizu jedno drugom, počinju da se popravljaju, a u takvom rangu krivice, optimalno je stati između njih.
Direktno prikazano na slici.

Što se tiče tipa donor-akceptor kovalentne veze, ako jedan po jedan dio donor predstavlja svoj elektronski par za vezu, a drugi, akceptor, je slobodna orbitala.
Također, kada je riječ o vrsti kovalentne veze, mogu se vidjeti nepolarne i polarne kovalentne veze, više detalja o njima će biti napisano u nastavku.
Kovalentna nepolarna veza
Oznaka kovalentne nepolarne veze je jednostavno veza koja se nalazi između dva identična atoma. Kraj nepolarne kovalentne veze vidi se na dijagramu ispod.
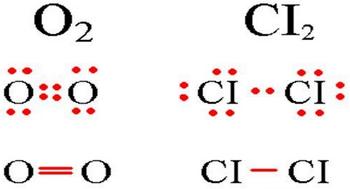
Dijagram kovalentne nepolarne veze.
Molekuli sa kovalentnom nepolarnom vezom imaju vruću elektronsku opkladu na jednake udaljenosti jezgara atoma. Na primjer, u molekulu kiselog (na dijagramu), atomi imaju osam elektronskih konfiguracija, s kojima smrad može biti čotiri zagalni opklade elektrona.
Govor s kovalentnim nepolarnim zvučnim zvukom ê plinovi, rídini ili porozna niskoletna tvrda rhechovina.
Kovalentna polarna veza
Sada treba da obezbedimo polarnu kovalentnu vezu. Također, uspostavlja se kovalentna polarna veza, ako kovalentno vezani atomi mogu biti električni različiti, a suspenzija elektrona se ne preklapa u dva atoma. Većinu vremena, većina elektrona je bliža jednom atomu, niže sljedećem. Može se vezati stražnji dio kovalentne polarne veze, koji krive molekule za hlor vode, postoje ogromni elektroni, koji su slični rastvoru kovalentne veze, šire se bliže atomu hlora, niže vode. I u redu je činjenica da je elektronegativnost hlora veća od elektronegativnosti vode.

Ovako izgleda shema kovalentne polarne veze.
Koristimo kraj govora sa polarnom kovalentnom vezom - vodom.
Kako označiti kovalentnu vezu
Pa, sada znate dokaze za ishranu, kako označiti kovalentnu polarnu vezu, a kako nepolarnu, za koga je dovoljno znati moć i hemijska formula molekula, kako se molekul sastoji od atoma raznih elemenata, onda će veza biti polarna, kao da je iz jednog elementa, tada će biti nepolarna. Takođe je važno zapamtiti da se kovalentne veze mogu kriviti samo za sredinu nemetala, zbog samog mehanizma kovalentnih veza, opisaćemo više.
Kovalentna veza, video
Í na kraju video predavanja o temi našeg članka, kovalentnoj vezi.
Kovalentna veza je ista hemijska veza koja se namiruje za ljusku užarenih elektronskih parova.
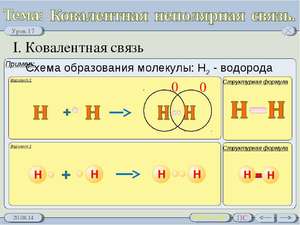
Pogledajmo mehanizam uspostavljanja kovalentne veze sa stražnjim dijelom molekule vode H2. Atomi mogu stvoriti elektronsku formulu: 1H1s1.
Kada su dva atoma blizu jedan drugom, interakcija dva elektrona sa antiparalelnim spinovima (označenim strelicama iz različitih pravaca) se posmatra iz formiranja globalne (podvučene) elektronske opklade.
Šema za uspostavljanje kovalentne veze može se prikazati navođenjem pogrešnog sparivanja elektrona jednakog za jednu tačku, a nesparenog elektronskog para za dvije tačke. Podijeliću par elektrona, tobto. kovalentna veza, koja se često naziva rižom. Polarni elektronski par nastaje kao rezultat preklapanja s-orbitala atoma u vodi, s kojim se stvara elektronski jaz u području preklapanja orbitala.
Pogledajmo uspostavljanje kovalentne veze u molekulu hlora Cl2. Atomi hlora imaju elektronsku formulu: 17Cl 1s2 2s2 2p6 3s2 3p5.
Atom hlora može imati jedan elektron na istom energetskom nivou, štaviše, postoji jedan nespareni elektron na 3p - jednak. Kada su dva atoma blizu hlora, primećuje se preklapanje 3p - orbitala sa nesparenim elektronima, što je uspostavljanje opklade varničkih elektrona. Koža atoma hlora u molekuli Cl2 zauzima tri nerazdvojena elektronska para (kao da leže na jednom atomu).
Molekul vode H2, kao i molekul hlora Cl2, ima jednostavnu (jednostruku) vezu. Isnuyut molekule, u kojima se između dva atoma nalaze dva ili tri elektronska para. Takve kovalentne veze nazivaju se podijeljene ili subtraktivne. Uobičajeni naziv podvarijante i trostrukih veza je višestruke veze.
Na primjer, možemo pogledati topljivost kovalentne veze u molekulu kisika O2. Atomi kiseli za pisanje elektronske formule: 8 O 1s2 2s2 2p4.
Atom je pun šest elektrona na vanjskom energetskom nivou, štaviše, na 2p - pogonu su dva nesparena elektrona. U otopljenoj hemijskoj vezi u molekulu O2 učestvuju dva elektrona kožnog atoma kiseline. Istovremeno se uspostavljaju dvije otvorene elektronske opklade (veza podzemne željeznice). Kožni atom kiseline u molekuli O2 štedi dvije nerazdvojene elektronske opklade.
Kada se kovalentna veza uspostavi u molekulu vode, koža se atomizira u vodu, sa stabilnom konfiguracijom od dva elektrona za rješavanje globalne elektronske opklade. U drugim slučajevima, kada se uspostavi kovalentna veza, na primjer, molekuli klora i kiselosti kože su atomi u stabilnoj konfiguraciji, koja se sastoji od osam elektrona.
U sva tri različita molekula (voda, hlor i kiselo) kovalentna veza se nastanila između atoma sa istom elektronegativnošću. Takva međuigra se čuva tokom osvjetljenja jednostavan govor-nemetaličiji su molekuli formirani od dva identična atoma, a ovdje se elektronske opklade visokog tona razmjenjuju simetrično između jezgara atoma, spajaju se. Na kraju kojih se uspostavljaju molekuli, u nekim centrima stvaraju se pozitivni i negativni naboji.
Od sada, kovalentna veza, koja se uspostavlja između atoma sa istom elektronegativnošću za ljusku visokih elektronskih parova, naziva se kovalentna nepolarna veza. Neophodno je zapamtiti da se ova vrsta hemijske veze uspostavlja u jednostavnim nemetalima. Kako primijeniti govor s kovalentnim nepolarnim tipom veze može se nazvati fluor F2, brom Br2, jod I2, dušik N2.
Kako atomi, kao da su međusobno promjenjivi, mogu imati različitu elektronegativnost (atomi različitih kemijskih elemenata), tada će se nabijeni elektronski par prebaciti na atom s većom elektronegativnošću. Pri tome se na atomima sa većom elektronegativnošću formira parcijalni negativni naboj, a na atomima sa manjom elektronegativnošću stvara se parcijalni pozitivan naboj. Broj parcijalnih naboja za apsolutne vrijednosti je manji od jedan.
Na primjer, kada se molekula vode otopi u HCl hloridu, s-orbitala atoma vode i p-orbitala atoma hlora se preklapaju. Centralni elektronski par je raspoređen asimetrično prema centrima atoma, koji mogu stupiti u interakciju. Otporniji je na elektronegativni hlor.
Djelomično negativno naelektrisanje nastaje na atomu hlora, a djelomično pozitivno na atomu vode. I ovdje se centri pozitivnih i negativnih naboja ne formiraju u molekuli. Takvi molekuli se nazivaju polarni ili dipoli. Dipol je sistem od dva naelektrisanja, koja su ista po veličini, ali suprotna po predznaku.
Od sada, kovalentna veza, koja se uspostavlja između atoma, čija je elektronegativnost otopljena, iako nedvosmisleno, naziva se kovalentna polarna veza. Neophodno je zapamtiti da se ova vrsta hemijske veze uspostavlja u savijenom govoru, formiranom od atoma nemetala. Kako primijeniti govore iz kovalentnog polarnog tipa veze može se nazvati voda fluorid HF, voda H2O, amonijak NH3, metan CH4, ugljični (IV) oksid CO2.
Za molekul sa kovalentnim tipom hemijske veze može se napisati elektronska strukturna (grafička) formula. Elektronska formula se sastoji od simbola hemijskih elemenata, na primjer, neke tačke se koriste za označavanje elektronskog nivoa, a između atoma - velika elektronska opklada. Strukturna (grafička) formula - ista formula, gdje je koža elektronskog para predstavljena rižom. Kao elektronska, i strukturna formula pokazuje redosled povećanja atoma u molekulu, njihove međusobne odnose.
Kovalentna veza. Polarne i nepolarne kovalentne veze
COVALENT LINK- tse link'yazyok, scho vinikaê mízh atoma za rahunnya zagalnih elektronskih parova (na primjer, H2, HCl, H2O, O2).
Iza faze pomaka elektronskih parova visokog tona na jedan od atoma koji su njima povezani, kovalentne veze mogu biti polarne i nepolarne.
a) KOVALENTNA NEPOLNA CRNA (CNS)- odobravaju atome jednog te istog hemijski element- Nemetalni (na primjer, H2, O2, O3).
Mehanizam brisanja veze.
Atom kože nemetala se vidi u dubokoj kori drugog atoma vanjskog uparivanja elektrona. Online opklade su podmirene. Elektronski par je isti za oba atoma.
Pogledajmo mehanizam rastvaranja molekula hlora:
Elektronska shema rastvaranja molekula Cl2:
Strukturna formula molekule Cl2:
σ
Cl - Cl, σ (p - p) - jedna veza

Pogledajmo mehanizam uspostavljanja kiselog molekula:
O2 - kns.
Elektronska shema eliminacije O2 molekula:
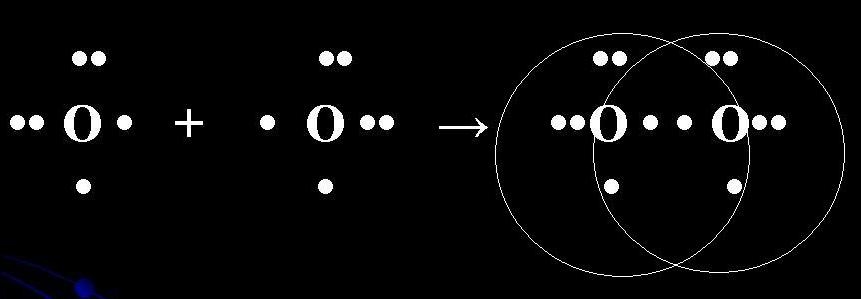
Strukturna formula molekule O2:
σ
O = O
π
Molekul ima višestruku, podsklopivu vezu:
Jedan σ (p – p)

onaj π (p - p)
B) KOVALENTNA POLARNA ZVIJEZDA (CPS)- Utvoruju atome raznih nemetala, koji su odgovorni za vrijednosti elektronegativnosti (na primjer, HCl, H2O).
Vinjatke rastu kada kovalentna veza čini atom nemetalom i metalom!
Na primjer, AlCl3, razlika u elektronegativnosti ∆ E.O.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Elektronegativnost (EO) - svrha snage atoma jednog elementa da privuče sebi elektrone iz atoma drugih elemenata. Najveći elektronegativni element je fluor F.
Elektronegativnost se može pokazati na više načina i inducirati elemente za redom za njen rast. Najčešće postoji niz elektronegativnih elemenata, koje je predložio američki hemičar L. Pauling.
sto. Elektronegativnost (EO) dejakih elemenata (dovodi u red rast EO).

Mehanizam brisanja veze.
Atom kože nemetala vidi duboku korozivnost drugog atoma sopstvenog nesparivanja elektrona. Online opklade su podmirene. Užareni elektronski par se pomiče na elektronegativni element.
Pogledajmo mehanizam rastvaranja molekula vode hlora:
HCl - kps.
Elektronska šema rastvora molekula HCl:

Ni za koga nije tajna da je hemija – nauka o njenom pravljenju sklopiva i, štaviše, raznomanitna. Anonimne različite reakcije, reagensi, hemikalije i drugi kolokvijalni i nerazumni termini - svi smrde jedno po jedno. Ale smut, scho s chemiêyu mi danas s pravom, bez obzira što čujemo od naših čitalaca u učionici i usvajamo novi materijal, ili ćemo skuhati čaj, koji je isparenja istog hemijskog procesa.
Možete zrobiti visnovok, sho hemiju je jednostavno neophodno znati Rozbiratsya u níy i plemenitosti, kao vlastovaniya naš svít abo yakís okremí yogo dijelovi - tsíkavo, í, više od toga, korisno.
U isto vrijeme, moramo se pozabaviti pojmom kao što je kovalentna veza, koja, u smislu govora, može biti i polarna i nepolarna. Prije govora, sama riječ "kovalentna" je uspostavljena jer latinsko "co" - odjednom i "vales" - mogu prisiliti.
Pojava termina
Pođimo od onoga što sam ja Termin "kovalentni" je prvi vijek star 1919. godine od strane roci Irvinga Langmuira. dobitnik Nobelove nagrade. Koncept "kovalentnog" prenosi hemijsku vezu, kada uvreda atoma može stvoriti elektron, koji se naziva uspavani volodin. U takvom rangu, tamo, na primjer, izgleda kao metal, u nekoj vrsti elektronike, ili u jonskom, de i zovsim jedan način elektronike na drugi način. Zatim označite šta je taloženo među nemetalima.
Na osnovu prethodno navedenog, možete dodati malu napomenu o onima koji su proces. Vaughn krivi atome ljuski za stvaranje spaljenih elektronskih parova, štoviše, za te parove okrivljuju se vanjski i vanjski elektroni.
Prijavite se, govori sa polara:
Vidite kovalentnu vezu
Također, postoje dvije vrste razlikovanja - polarna, i, vidpovidno, nepolarna veza. Osobenosti kože su okremo.
Kovalentno polarno - svjetlo
Šta je pojam "polarni"?
 Zvuk tako da dva atoma mogu biti električno negativna, dakle, svijetli elektroni ih ne preklapaju, već su bliže jednom, niže drugom. Na primjer, molekul klorove vode, u kojoj je kovalentna elektronska veza bliža atomu klora, njeni dijelovi su elektronegativniji, niži u vodi. Međutim, u stvari, razlika u težini elektrona nije velika, tako da bi transfer elektrona iz vode u hlor bio van.
Zvuk tako da dva atoma mogu biti električno negativna, dakle, svijetli elektroni ih ne preklapaju, već su bliže jednom, niže drugom. Na primjer, molekul klorove vode, u kojoj je kovalentna elektronska veza bliža atomu klora, njeni dijelovi su elektronegativniji, niži u vodi. Međutim, u stvari, razlika u težini elektrona nije velika, tako da bi transfer elektrona iz vode u hlor bio van.
Kroz rat s polaritetom, elektronski jaz se pomiče na elektronegativniji, s malo više negativnog naboja. U svojoj srži, u tom jezgru, čija je elektronegativnost niža, to je zbog općenito čestog pozitivnog naboja.
Robimo visnovok: polaritet je kriv između različitih nemetala, koji su odgovorni za vrijednosti elektronegativnosti, a elektroni su bliži jezgru s većom elektronegativnošću.
Elektronegativnost - sposobnost nekih atoma da privlače elektrone drugih na sebe, čime se olakšava kemijska reakcija.
Nanesite kovalentni polar, govor sa kovalentnom polarnom vezom:
Formula govora sa kovalentnom polarnom vezom
Kovalentno nepolarno, razlika između polarnog i nepolarnog
Ovdje sam, nepolarni, uskoro ćemo znati šta zamišljate.
Glavna karakteristika nepolarnog kao polarnog- ce simetrija. Dok su u slučaju polarnog elektrona elektroni raspoređeni bliže jednom atomu, onda su kod nepolarne veze elektroni raspoređeni simetrično, tako da su u jednakom svijetu, prema omjeru, do oba.
Važno je napomenuti da je nepolarna interakcija između atoma nemetala jednog hemijskog elementa.
Na primjer, govor s nepolarnom kovalentnom vezom:
Takođe, skup elektrona se često naziva jednostavno elektronskim mrkom, jer je to robimo visnovok, jer je elektronski mrak povezan, kao da je uspostavljen par elektrona, širi se simetrično u prostoru, odnosno ravnomerno prema odnosu na oba jezgra. .
Nanesite kovalentnu nepolarnu vezu
Ale također poznaje plemstvo, jer se pravi razlika između kovalentno polarnog i nepolarnog.
kovalentne nepolarne- Tse zavzhdi atom i jedan tíêí̈ th govor. H2. CL2.
Na koji članak je nauka stigla, sada znamo šta zamišljamo ovaj hemijski proces, iako možemo označiti tu i tu raznolikost, znamo formule za razrješenje govora, i još malo o našem preklopnom svjetlu, uspjehu u hemijske formulacije.
Vrsta hemijske veze
kovalentna: nepolarni, polarni, donor-akceptor.
Ionna
Metaleva
Vodneva
kovalentna veza
Kovalentna veza (atomska veza, homeopolarna veza) - hemijska veza, rješenja za preklapanje (agregiranje) parivalentne elektronske hmar. Elektronski mrak (elektronika), koji čini veze bezbednim, nazivaju se vrućim elektronskim parom.
Jednostavnu kovalentnu vezu uspostavljaju dva nesparena valentna elektrona, za jedan
tip atoma kože:
A + B → A: B
Kao rezultat toga, ususpilennya elektronike je odgovorna za nivo energije. Prsten će biti sređen, kao da će njihova ukupna energija biti manja na svakom jednakom, niže u taboru klipa (a razlika u energiji neće biti ništa manja, kao energija karike).
Kovalentni nepolarni (nemetal-nemetal)
Međutim, kao i atomi koji čine jednostavnu kovalentnu vezu, pravi naboj atoma molekule je isti, krhotine atoma koje čine vezu, međutim, mogu biti nabijeni elektronski par. Takva veza se naziva nepolarna kovalentna veza. Takva veza se može lako izgovoriti, na primjer, O2, N2, Cl2. Ali, ne samo nebacači istog tipa mogu formirati kovalentnu nepolarnu vezu. Kovalentna nepolarna veza također može formirati elementarne nemetale, čija elektronegativnost može biti jednako važna, na primjer, u PH3 molekulima veza kovalentne nepolarne , komadići EO vode ne dodaju EO fosforu.
Kovalentno polarni (EOₐ≠EOₓ)
Kako su atomi različiti, tada je korak vlakna okružen parom elektrona, koji se razlikuje po razlici u elektronegativnosti atoma. Atom sa većom elektronegativnošću jače privlači k sebi par elektrona, a taj drugi naboj postaje negativan. Atom s manjom elektronegativnošću nabuvaê, očito, takav pozitivan naboj po veličini. Ako je veza uspostavljena između dva različita nemetala, tada se takva polovina naziva kovalentna polarna veza .
Donor-akceptor
Donor-akceptorski mehanizam (također poznat kao mehanizam koordinacije) - metoda uspostavljanja kovalentne hemijske veze između dva atoma ili grupe atoma, koja radi za ravnotežu nepodijeljenog para elektrona atoma donora i slobodnog atoma-orbitale .
Termini „donator-akceptorska veza” ili „koordinacione veze” nisu tačni, ali ne kao vrsta hemijske veze, već kao teorijski model koji opisuje specifičnost njenog nastanka. Dominacija kovalentne hemijske veze, uspostavljene iza mehanizma donor-akceptor, ni po čemu se ne razlikuje od dominacije veza uspostavljene iza mehanizma razmene (na primer, NH veza u jon-amonijum NH4+ ili O -H3-jon u O-3-promaji).
Složeni neorganski kation na pola igra ulogu jednovalentnog metala. Hemijska formula je NH4+. Kada se amonijak razlikuje u kiselinama, javlja se sljedeća reakcija:
NH3 + H+ = NH4+
^
Hidroksonijum (oksonijum, hidronijum) H3O+ je kompleksni jon, koji povezuje proton sa molekulom vode.
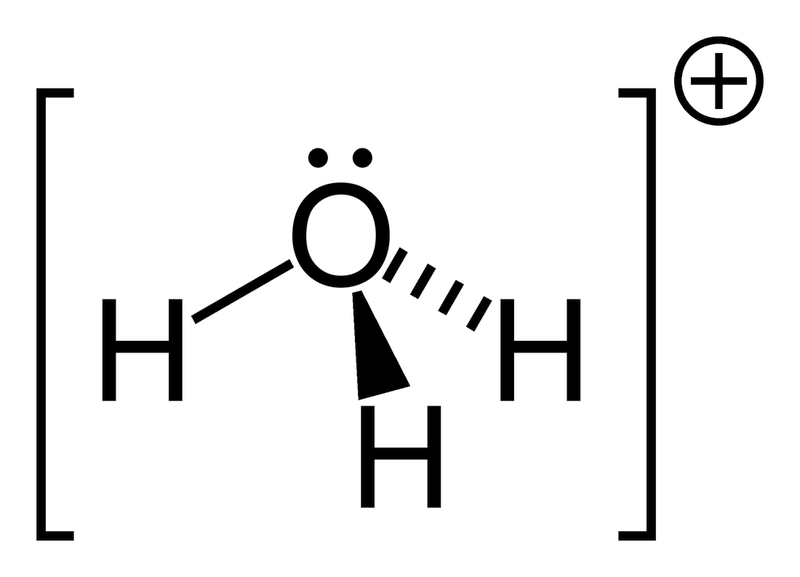
Donori zvuče kao atomi azota, kiseonika, fosfora, sirki i dr. Ulogu akceptora može odigrati jonizacija H+ atoma, p-metala (npr. aluminijuma sa otopljenim AlH4- jonom), a posebno d-elemenata, koji možda ne ispunjavaju energetsku sredinu valentna elektronska lopta.
Sam položaj mehanizma donor-akceptor opisuje uspostavljanje lokaliziranih kovalentnih veza u molekulima i molekularnim ionima kompleksnih (koordinacijskih) mjesta: veze se formiraju iza kvadrata nepodijeljenog para elektrona u ligandu i primarnom orbitalnom kompleksu. atoma. Mehanizam donor-akceptor također označava eliminaciju međuproizvoda (intermedijara) reakcije, na primjer, kompleksa sa prenesenim nabojem.
Model mehanizma donor-akceptor koristi se samo u okviru fenomena valencije kao lokalizacije elektronskog jaza u prisustvu kovalentnih veza (metoda valentnih šema). Na granicama metode molekularnih orbitala nema potrebe za sličnim manifestacijama.
^
II. Jonski zvuk (metal-nemetal)
Íonny zv'yazok - mítsny khímíchny zv'yazok, koji se uspostavlja između atoma s velikom razlikom ( >1,7
prema Paulingovoj skali) elektronegativnosti, sa svijetlim elektronskim parom, vjerojatnije je da će prijeći na atom sa većom elektronegativnošću. Tse tyazhinnya ioniv yak raznoimenno zagrazzhenih tíl. CsF se može koristiti kao kundak, za koji je “nivo joničnosti” 97%. Elektronska konfiguracija atoma natrijuma i hlora može se detektovati: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 3s2 3p5
Kao atomi iz nedovršenih energetskih jednakosti. Očigledno je da je atomu natrija lakše primiti jedan elektron, niže da primi ovaj, a atomu hlora je lakše primiti jedan elektron, niže da primi ovaj. Prilikom interakcije, atom natrija odaje jedan elektron, a atom hlora uzima jedan elektron. Šematski se može napisati na sljedeći način: Naº - l e -> Na + natrijum jon, osmoelektronska stabljika 1s2 2s2 2p6 ljuska za ljusku drugog energetskog nivoa.
Clº + 1e → Cl¯- jon do hlora, postolje je ljuska od osam elektrona. Između Na+ i Cl- jona okrivljuju se sile elektrostatičke gravitacije i kao rezultat toga se uspostavlja kontrakcija. Jonska veza je ekstremna polarizacija kovalentne polarne veze. Smješten između tipičnih metala i nemetala.
Uz pomoć elektrona, veća je vjerovatnoća da će metal prijeći na nemetal. Oni su podmireni - naplaćeni dijelovi.
Ako se uspostavi hemijska veza između atoma, ako može postojati čak i velika razlika u elektronegativnosti (EO > 1,7 prema Paulingu. EO tabela je predstavljena ispod), tada će elektronski par vjerovatnije preći na atom s većim EO . Rezultat toga je razlučivanje naboja jona na isti način:
Između jona koji su se smjestili, kriva je elektrostatička gravitacija, kako se naziva jonski zvuk. Tačnije, takav izgled je zruchny. Zaista, ionska veza između atoma na čist način se ne ostvaruje nigdje, ili možda nigdje, zvuči kao da je prava veza često jonske, a često i kovalentne prirode. Upravo u tom času, veze sklopljenih molekularnih jona često se mogu smatrati čisto jonskim. Najvažnija svojstva jonske veze u odnosu na druge tipove hemijskih veza odnose se na neusmjerenost i nezasićenost. Isto tako, kristali, napravljeni za rahunke jonske veze, teški su za razne male pakete živih jona.
Karakteristika sličnih klica je dobra svestranost kod polarnih trgovaca (voda, kiseline i voda). Zavisi od naboja elemenata molekula. Sa bilo kojim dipolom tvorca, molekuli se privlače na krajeve naboja i, kao rezultat Brownovog pokreta, „razvlače“ molekul govora na dijelove i ostavljaju ga bez davanja novog početka. Kao rezultat, čini se da su izbrušeni dipolima trgovca. 
^ Metalevy zvez'azok
Metalni zv'yazok - hemijski zv'yazok, zumovnistyu shkodo slobodnih elektrona. Tipičan je kako za čiste metale tako i za sve legure i intermetalne slojeve.
Metalni mehanizam za povezivanje
U svim čvorovima kristalnih zrna šire se pozitivni ioni metala. Između njih, valentni elektroni kolabiraju poput molekula plina, koji su bili podijeljeni na atome kada su joni uspostavljeni. Qi elektroni igraju ulogu cementa, ističući pozitivne ione odjednom; u drugom padu grati se raspao pod uticajem sila vazduha između jona. U isto vrijeme, elektroni su utjelovljeni jonima na granicama kristalnih kratera i ne mogu napustiti. Snaga veze nije lokalizirana i nije ispravljena. Zbog toga se prikazuju najveći koordinacijski brojevi (na primjer, 12 sati 8).
Veći broj metala čini jednu od naprednih visokosimetričnih traka iz uskog pakovanja atoma:
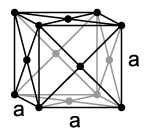
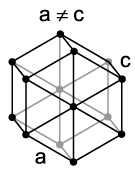
kubna zapremina centrirana, kubična površina centrirana i heksagonalna.
U zrnima sa kubičnim volumenom (BCC), atomi su raspoređeni na vrhovima kocke i jedan atom u centru zapremine kocke. Kubne zapreminske centrirane mase metala: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba i in.

Kod kubičnih otvora usmjerenih na lice (FCC) atomi su mljeveni na vrhovima kocke iu centru površine kože. Rešetke ovog tipa mogu lijevati metal: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co i in.
U heksagonalnom rješenju, atomi su naborani na vrhovima i središtima heksagonalnih osnova prizme, a tri atoma su u srednjoj ravni prizme. Takvo pakiranje atoma može biti metal: Mg, -Ti, Cd, Re, Os, Ru, Zn, -Co, Be, -Ca i in.
moć
Elektronika, koja se slobodno kolabira, ima visoku električnu i toplotnu provodljivost. Govor, koji može da napravi metalnu kariku, često kombinuje plastičnost sa plastičnošću, tako da kada se atomi izmeste u jednoj, ne vidi se razvoj karika.
^
IV. Poziv vode
Poziv vode- oblik asocijacije između elektronegativnog atoma i atoma vode H, kovalentno vezanog s trećim elektronegativnim atomom. Kao elektronegativni atomi, mogu djelovati kao N, O ili F. Vodene veze mogu biti intermolekularne ili intramolekularne.
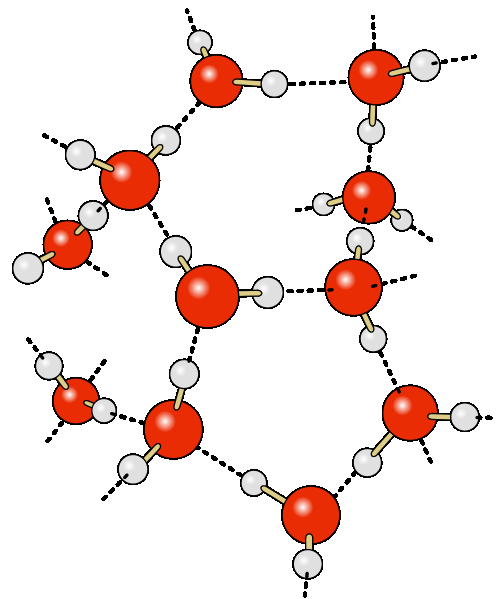
Često se vodene veze posmatraju kao elektrostatička interakcija, jaka sa malom količinom vode, što omogućava blizinu međusobnih dipola. Na isti način da se govori o drugačijoj vrsti donor-akceptorske veze, nevalentnoj interakciji između atoma vode H, kovalentno vezanog za atom A groupie A-H RA-H molekule i elektronegativni B atom druge molekule (ili funkcionalne grupe istog molekula) BR". fragmenti RA i BR".
Osobitosti vodene veze, za koju íí̈ se vidi u okremy viglyad, ê í̈í̈ ni manje ni više nego visok mítsníst, í̈ širina i važnost, posebno u organskim poljima, kao i akti nuspojave povezane s malim veličinama i prisustvom dodatnih elektrona u vodi.
Energija vodene veze je znatno manja od energije velike kovalentne veze (ne prelazi 40 kJ/mol). Međutim, ima dovoljno energije da se dovede do povezivanja molekula, tako da se mogu kombinirati u dimere ili polimere. Sama povezanost molekula sa izazivanjem abnormalnosti visoke temperature topljenje i ključanje takvih govora, kao što su fluorovodonik, voda, amonijak.
Veze ovog tipa, iako slabe za jonske i kovalentne veze, štite, igraju još važniju ulogu u unutrašnjim i međumolekularnim interakcijama. Vodene veze su bogate onim što su lude Fizička snaga voda i bogata organska jedinjenja (alkoholi, karboksilne kiseline, amidi karboksilnih kiselina, kolabibilni etri).
Toplotni kapacitet vode je nenormalno visok, a toplotna provodljivost bogatih atomskih alkohola osigurana je numeričkim vodenim vezama. Jedan molekul vode može stvoriti do neke od klasičnih vodenih veza iz sucida.
Vodene veze povećavaju tačku ključanja, viskozitet i površinski napon vode. Voddneví zv'yazki vídpovídalní za mnoge druge jedinstvene moći vode.
Iz sadašnjih događaja razumno je da se prisustvo vodenih veza između molekula vode može nazvati do tačke opravdanja takozvanih vodenih klastera ili kompleksa. Najjednostavniji primjer takvog klastera može biti vodeni dimer:
voda je mreža molekula H2O povezanih vodenim vezama.

Kada se voda zamrzne, stvara se mnogo vodenih zvukova:
![]()
Vodene veze u molekulima leda:
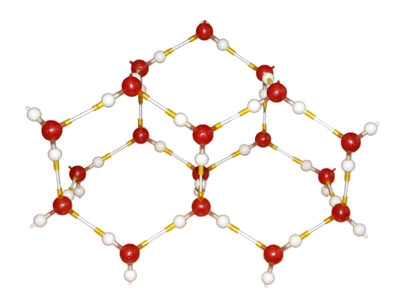
Vodene veze između molekula organskih kiselina:

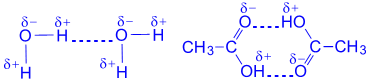
Vodene veze kod vjeverica:

