Сторінка 1
Надлишок сірководню видаляють пропусканням двокису вуглецю. Сірку, що виділилася, відфільтровують; у разі потреби розчин попередньо кип'ятять, щоб сірка коагулювала.
Надлишок сірководню видаляється при кип'ятінні розчину. Цей спосіб має обмежене застосування, оскільки багато елементів осідають сірководнем; крім того, при цьому виділяється осад сірки, який заважає титруванню.
Надлишок сірководню видаляється при кип'ятінні розчину. Цей спосіб має обмежене застосування, оскільки багато елементів осаджуються сірководнем; крім того, при цьому виділяється осад сірки, який заважає титруванню.
Надлишок сірководню - S35 з генератора газу може бути використаний.
Наявність надлишку сірководню, що перевищує концентрацію, необхідну для сульфідування та активації каталізатора, також зменшує швидкість гідрогенолізу інших сірковмісних сполук. У сіркоочищенні Аі-Сі-Аі типу закритий сендвіч сірководень адсорбується першим шаром окису цинку і, отже, не впливає на реакцію гідрування на кобальт-молібденовому каталізаторі. При розрахунку об'ємної швидкості в системі гйдроочищення проектувальниками повинна бути прийнята до уваги концентрація сірководню в газі, що гідрує.
При пропущенні надлишку сірководню в підкислений соляною кислотою розчин солі тривалентного миш'яку вийшов золь трисірчистого миш'яку.
При пропущенні надлишку сірководню в підкислений соляною кислотою розчин солі миш'яку (III) вийшов золь трисірчистого: миш'яку.
При пропущенні надлишку сірководню в підкислений соляною кислотою розчин солі миш'яку (III) утворився золь трисірчистого миш'яку.
Тому дія надлишку сірководню на спиртово-аміачний розчин галоїдної солі може бути способом відновлення її в тріаріл-стибін. Якщо бажають зупинити реакцію на стадії утворення сірчистої тріарілсурма, то її проводять наступним чином.
Для видалення надлишку сірководню пробу нагрівають на плитці; його відсутність фіксують свинцевим папірцем. Осади сульфідів міді, заліза, паладію відфільтровують. У безбарвному фільтраті визначають аніони хлору. Для цього до фільтрату додають 10 - 20 мл 0 2 і.
Суміш нагрівають для видалення надлишку сірководню, нейтралізують вуглекислим барієм, фільтрують теплою, а фільтрат згущують до об'єму 40 куб. Розчин (здебільшого коричневого кольору) залишають стояти і якщо наступного дня не виділяються кристали, його поміщають в ексикатор над сірчаною кислотою. Кристали, що виділилися, розтирають з 20 частинами 90% - ного спирту. Розчин відфільтровують, випарюють і отриманий арбутин перекристалізовують з гарячої води, додавши до розчину тваринного вугілля. Кристалізацію ведуть до тих пір, поки не буде виходити абсолютно безбарвний розчин.
Розчин після деякого стояння повинен містити надлишок сірководню. Проба фільтрату повинна давати після підкасування оцтовою кислотою рясний чорний осад з оцтовокислим свинцем.
Розчин після деякого стояння повинен містити надлишок сірководню. Проба фільтрату повинна давати після підкислення оцтовою кислотою рясний чорний осад з оцтовокислим свинцем.
ВИЗНАЧЕННЯ
Сірководнева кислота(сірководень, моносульфан) в звичайних умовахє безбарвним газом.
Термічно нестійкий. Погано розчинний у холодній воді. Насичений розчин (0,1М) називають « сірководневою водою», який каламутніє при стоянні на повітрі. Виявляє слабкі кислотні властивості. В ОВР є сильним відновником.
Хімічна формула сірководневої кислоти
Хімічна формуласірководневої кислоти H 2 S. Вона показує, що до складу цієї молекули входять два атоми водню (Ar = 1 а.е.м.) та один атом сірки (Ar = 32 а.е.м.). За хімічною формулою можна обчислити молекулярну масу сірководневої кислоти:
Mr(H 2 S) = 2×Ar(H) + Ar(S);
Mr(H2S) = 2×1 + 32 = 2 +32 = 34.
Графічна (структурна) формула сірководневої кислоти
Структурна (графічна) формула сірководневої кислоти є наочнішою. Вона показує, як пов'язані атоми між собою всередині молекули (рис. 1).
Мал. 1. Будова молекули сірководню із зазначенням валентного кута між зв'язками та довжини хімічних зв'язків.
Іонна формула
Сірководнева кислота є електролітом, тобто. у водному розчині вона здатна дисоціювати на іони відповідно до наступного рівняння:
H 2 S ↔ 2H + + S 2- .
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Визначте молекулярну формулу сполуки, що містить 49,4% калію, 20,2% сірки, 30,4% кисню, якщо відносна молекулярна маса цієї сполуки у 3,95 рази більша від відносної атомної маси кальцію. |
| Рішення |
Позначимо кількість моль елементів, що входять до складу з'єднання за «х» (калій), «у» (сірка) та «z» (кисень). Тоді мольне ставлення буде виглядати наступним чином (значення відносних атомних мас, взятих з Періодичної таблиці Д.І. Менделєєва, округлим до цілих чисел): x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O); x: y: z = 49,4/39: 20,2/32: 30,4/16; x: y: z = 1,3: 0,63: 1,9 = 2: 1: 3. Значить найпростіша формула сполуки калію, сірки та кисню матиме вигляд K 2 SO 3 та молярну масу 158 г/моль. Знайдемо справжню молярну масу цієї сполуки: M substance = Ar(Ca) 3,95 = 40 3,95 = 158 г/моль. Щоб знайти істинну формулу органічної сполуки знайдемо відношення отриманих молярних мас: M substance / M (K 2 SO 3) = 158/158 = 1. Значить формула сполуки калію, сірки та кисню має вигляд K 2 SO 3 . |
| Відповідь | K 2 SO 3 |
ПРИКЛАД 2
| Завдання | До складу речовини входить 32,5% натрію, 22,5% сірки та 45% кисню. Виведіть хімічну формулу речовини. |
| Рішення | Масова частка елемента Х у молекулі складу НХ розраховується за такою формулою: ω (Х) = n × Ar (X) / M (HX) × 100%. Позначимо кількість моль елементів, що входять до складу сполуки за «х» (натрій), «у» (сірка) та «z» (кисень). Тоді мольне ставлення буде виглядати наступним чином (значення відносних атомних мас, взятих з Періодичної таблиці Д.І. Менделєєва, округлим до цілих чисел): x:y:z = ω(Na)/Ar(Na) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 32,5/23: 22,5/32: 45/16; x: y: z = 1,4: 0,7: 2,8 = 2: 1: 4. Значить формула сполуки натрію, сірки та кисню матиме вигляд Na 2 SO 4 . Це сульфат натрію. |
| Відповідь | Na 2 SO 4 |
Сера - елемент 16-ї групи (за застарілою класифікацією - головною підгрупою VI групи), третього періодуперіодичної системи хімічних елементівД. І. Менделєєва, з атомним номером 16. Виявляє неметалеві властивості. Позначається символом S (лат. sulphur). У водневих і кисневих сполуках знаходиться у складі різних іонів, утворює багато кислот і солі. Багато сірковмісних солей малорозчинні у воді.
Природні мінерали сірки
Сірка є шістнадцятим за хімічною поширеністю елементом у земній корі. Зустрічається у вільному (самородному) стані та пов'язаному вигляді.
Найважливіші природні сполуки сірки: FeS 2 – залізний колчедан або пірит, ZnS – цинкова обманка або сфалерит (вюрцит), PbS – свинцевий блиск або галеніт, HgS – кіновар, Sb 2 S 3 – антимоніт. Крім того, сірка присутня в нафті, природному вугіллі, природних газах та сланцях. Сірка - шостий елемент за вмістом у природних водах, зустрічається в основному у вигляді сульфат-іону і зумовлює «постійну» жорсткість прісної води. Життєво важливий елемент для вищих організмів, складова частина багатьох білків, концентрується у волоссі.
Сірка суттєво відрізняється від кисню здатністю утворювати стійкі ланцюжки та цикли з атомів. Найбільш стабільні циклічні молекули S 8 мають форму корони, що утворюють ромбічну і моноклинну сірку. Це кристалічна сірка - тендітна речовина жовтого кольору. Крім того, можливі молекули із замкнутими (S 4 , S 6) ланцюгами та відкритими ланцюгами. Такий склад має пластична сірка, речовина коричневого кольору, яка виходить при різкому охолодженні розплаву сірки (пластична сірка вже через кілька годин стає крихкою, набуває жовтого кольору і поступово перетворюється на ромбічну). Формулу сірки найчастіше записують просто S, оскільки вона, хоч і має молекулярну структуру, є сумішшю простих речовин з різними молекулами. У воді сірка нерозчинна, деякі [які?] її модифікації розчиняються в органічних розчинниках, наприклад, у сірковуглецю, скипидарі. Плавлення сірки супроводжується помітним збільшенням обсягу (приблизно 15%). Розплавлена сірка є жовтою легкорухливою рідиною, яка вище 160 °C перетворюється на дуже в'язку темно-коричневу масу. Найбільшої в'язкості розплав сірки набуває при температурі 190 °C; подальше підвищення температури супроводжується зменшенням в'язкості та вище 300 °C розплавлена сірка знову стає рухомою. Це з тим, що з нагріванні сірки вона поступово полімеризується, збільшуючи довжину ланцюжка з підвищенням температури. При нагріванні сірки понад 190 ° C полімерні ланки починають руйнуватися. Сірка може бути найпростішим прикладом електрета. При терті сірка набуває сильного негативного заряду.
Горіння сірки
На повітрі сірка горить, утворюючи сірчистий ангідрид - безбарвний газ із різким запахом:
За допомогою спектрального аналізу встановлено, що насправді процес окислення сірки в двоокис є ланцюговою реакцією і відбувається з утворенням низки проміжних продуктів: моноокису сірки S 2 O 2 , молекулярної сірки S 2 , вільних атомів сірки S і вільних радикалів моноокису сірки SO .
Відновлювальні властивості сірки проявляються в реакціях сірки та з іншими неметалами, проте при кімнатній температурі сірка реагує лише з фтором:
Розплав сірки реагує з хлором, при цьому можливе утворення двох нижчих хлоридів:
При нагріванні сірка також реагує з фосфором, утворюючи суміш сульфідів фосфору, серед яких вищий сульфід P 2 S 5:
Крім того, при нагріванні сірка реагує з воднем, вуглецем, кремнієм:
(сірководень)
(сірковуглець)
При нагріванні сірка взаємодіє з багатьма металами, часто дуже бурхливо. Іноді суміш металу із сіркою загоряється при підпалюванні. При цьому взаємодії утворюються сульфіди:
Розчини сульфідів лужних металів реагують із сіркою з утворенням полісульфідів:
Зі складних речовин слід відзначити насамперед реакцію сірки з розплавленою лугом, в якій сірка диспропорціонує аналогічно хлору:
Отриманий метал називається сірчаною печінкою.
З концентрованими кислотами-окислювачами (HNO 3 , H 2 SO 4) сірка реагує лише при тривалому нагріванні:
Біологічна роль
Сірка - один із біогенних елементів. Сірка входить до складу деяких амінокислот (цистеїн, метіонін), вітамінів (біотин, тіамін), ферментів. Сірка бере участь у освіті третинної структури білка (формування дисульфідних містків). Також сірка бере участь у бактеріальному фотосинтезі (сірка входить до складу бактеріохлорофілу, а сірководень є джерелом водню). Окисно-відновні реакції сірки - джерело енергії в хемосинтезі.
Людина містить приблизно 2 г сірки на 1 кг своєї ваги.
Сірководень (сірчистий водень, сульфід водню, дигідросульфід) - безбарвний газ із запахом протухлих яєць та солодкуватим смаком. Хімічна формула - H 2 S. Погано розчинний у воді, добре - в етанолі. Отруйний. При великих концентраціях роз'їдає багато металів. Концентраційні межі займання із повітрям становлять 4,5 - 45 % сірководню.
У природі зустрічається дуже рідко у вигляді змішаних речовин нафти та газу. Входить до складу вулканічних газів. Утворюється при гниття білків. Сірководень використовують у лікувальних цілях, наприклад сірководневих ваннах.
Фізичні властивості
Термічно стійкий (при температурах більше 400 °C розкладається на прості речовини- S та H 2). Молекула сірководню має кутову форму, тому вона полярна (μ = 0,34 · 10 -29 Кл · м). На відміну від молекул води, атоми водню в молекулі не утворюють міцних водневих зв'язків, тому сірководень є газом. Розчин сірководню у воді – дуже слабка сірководнева кислота.
Хімічні властивості
Власна іонізація рідкого сірководню мізерно мала.
У воді сірководень мало розчинний, водний розчин H 2 S є дуже слабкою кислотою:
Ka = 6.9·10 −7 моль/л; pK a = 6.89.
Реагує з основами:
(звичайна сіль, при надлишку NaOH)
(кисла сіль, щодо 1:1)
Сірководень – сильний відновник. На повітрі горить синім полум'ям:
при нестачі кисню:
(На цій реакції заснований промисловий спосіб отримання сірки).
Сірководень реагує також з багатьма іншими окислювачами, при його окисленні в розчинах утворюється вільна сірка або SO 4 2− , наприклад:
Сульфіди
Солі сірководневої кислоти називають сульфідами. У воді добре розчиняються лише сульфіди лужних металів, амонію. Сульфіди інших металів практично не розчиняються у воді, вони випадають в осад при введенні в розчини солей металів розчину сульфіду амонію (NH 4) 2 S. Багато сульфідів яскраво забарвлені.
Для лужних та лужноземельних металів відомі також гідросульфіди M + HS та M 2+ (HS)². Гідросульфіди Са²+ та Sr 2+ дуже нестійкі. Будучи солями слабкої кислоти, розчинні сульфіди піддаються гідролізу. Гідроліз сульфідів, що містять метали у високих ступенях окиснення, або гідроксиди яких є дуже слабкими основами (наприклад, Al 2 S 3 , Cr 2 S 3 та ін) часто проходить незворотно.
Багато природних сульфідів у вигляді мінералів є цінними рудами (пірит, халькопірит, кіновар).
Отримання
· Взаємодіям розведених кислот із сульфідами:
· Взаємодія сульфіду алюмінію з водою (ця реакція відрізняється чистотою отриманого сірководню):
· Сплавлення парафіну з сіркою.
4. Сірка
Властивості 16 S.
|
Атомна маса |
кларк, ат.% (поширеність у природі) |
||
|
Електронна конфігурація* |
Агрегатний стан |
тверда речовина |
|
|
Енергія іонізації
|
|||
|
Відносна електронегативність |
густина |
||
|
Можливі ступені окислення |
2,+1,+2, +3, +4,+6 |
Стандартний електродний потенціал |
*Наведено конфігурацію зовнішніх електронних рівнів атома елемента. Конфігурація інших електронних рівнів збігається з такою для благородного газу, що завершує попередній період і вказаний у дужках.
Знаходження у природі.
Сірка широко поширена у природі. Вона становить 0,05 % маси земної кори. У вільному стані (самородна сірка) у великих кількостяхзустрічається в Італії (острова Сицилія) та США. Родовища самородної сірки є у Поволжі, державах Середню Азію, Криму та інших районах.Сірка часто зустрічається як сполуки з іншими елементами. Найважливішими її природними сполуками є сульфіди металів: FeS 2 - залізний колчедан, або пірит; ZnS - цинкова обманка; PbS - свинцевий блиск; HgS - кіновар та ін, атакож солі сірчаної кислоти (кристаллогідрати): Са SO 4 Ч 2Н 2 O - гіпс, Na 2 SO 4 Ч 10H 2 O -глауберова сіль, М gS Про 4 Ч 7H 2 O -гірка сіль та ін.
Сірка міститься в організмах тварин та рослин, оскільки входить до складу білкових молекул. Органічні сполуки сірки містяться у нафті.
Фізичні властивості. Сірка - тверда крихка речовина жовтого кольору. У воді практично нерозчинна, але добре розчиняється в сірковуглецю, аніліну та деяких інших розчинниках. Погано проводить теплоту та електрику. Сірка утворює кілька алотропних модифікацій - сірка ромбічна, моноклінна, пластична.Найбільш стійкою модифікацією є ромбічна сірка, на неї мимоволі через деякий час перетворюються всі інші модифікації.
При 444,6 ° С сірка кипить, утворюючи пари темно-бурого кольору. Якщо їх швидко охолодити, виходить тонкий порошок, що складається з дрібних кристалів сірки, званий сірчаним кольором.
Природна сірка складається із суміші чотирьох стійких ізотопів:
Хімічні властивості.
Сірка може віддавати свої електрони при взаємодії з сильнішими окислювачами:
У цих реакціях сірка є відновником. Потрібно наголосити, що оксид сірки
(VI) може утворюватися лише у присутності Pt або V 2 O 5 та високому тиску .При взаємодії з металами сірка виявляє окислювальнівластивості:
![]()
З більшістю металів сірка реагує при нагріванні, але реакції з ртуттю взаємодія відбувається вже за кімнатної температурі. Ця обставина використовується в лабораторіях для видалення розлитої ртуті, пари якої є сильною отрутою.
Застосування. Сірка широко застосовується у промисловості та сільському господарстві. Близько половини її видобутку витрачається для одержання сірчаної кислоти. Використовують сірку для вулканізації каучуку: каучук набуває підвищеної міцності та пружності. У вигляді сірчаного кольору (тонкого порошку) сірка застосовується для боротьби з хворобами виноградника та бавовнику. Вона використовується для отримання пороху, сірників, складів, що світяться. У медицині готують сірчані мазі для лікування шкірних захворювань.
Сірководень, сірководнева кислота, сульфіди. При нагріванні сірки з воднем відбувається оборотна реакція:
з дуже малим виходом сірководню
H 2 S. Зазвичай Н 2 S одержують дією розведених кислот на сульфіди:Цю реакцію часто проводять в апараті Кіппа.
Фізичні властивості. Сірководень Н
2 S - безбарвний газ із запахом тухлих яєць, отруйний. Один об'єм води за звичайних умоврозчиняє 3 обсяги сірководню.Сірководень - дуже отруйний газ, що вражає нервову систему. Тому працювати з ним треба у витяжних шафах або з приладами, що герметично закриваються. Допустимий зміст H 2 S у виробничих приміщеннях становить 0,01 мг на 1 л повітря.Розчин сірководню а воді називається сірководневою водоюабо сірководневої кислоти(Вона виявляє властивості слабкої кислоти).
Хімічні властивості. Сірководень - типовий відновник.У кисні він згоряє. Розчин сірководню у воді є дуже слабкою сірководневою кислотою, яка дисоціює ступінчасто і в основному по першому щаблі:

Сірководнева кислота, як і сірководень, - типовий відновник.
Сірководнева кислота окислюється не тільки сильними окислювачами, наприклад, хлором,
але й слабшими, наприклад сірчистою кислотою
H 2 SO 3:або іонами тривалентного заліза:
Сірководнева кислота може реагувати з основами, основними оксидами або солями, утворюючи два ряди солей: середні - сульфіди,кислі - гідросул'фіди.Більшість сульфідів (за винятком сульфідів
лужних і лужноземельних металів, а також сульфіду амонію) погано розчиняється у воді. Сульфіди,як солі дуже слабкої кислоти, що піддаються гідролізу.Знаходження у природі. Сірководень зустрічається в природі у вулканічних газах і водах деяких мінеральних джерел, наприклад П'ятигорська, Мацести. Він утворюється при гниття сірковмісних органічних речовин різних рослинних та тваринних залишків. Цим пояснюється характерний неприємний запах стічних вод, вигрібних ям і сміттєзвалищ.
Сульфіди. Наприклад,
Na 2 S - сульфід натрію, NaHS - гідросульфід натрію.Гідросульфіди майже всі добре розчиняються у воді. Сульфіди лужних і лужноземельних металів також розчиняються у воді, а інших металів практично нерозчинні або мало розчинні; деякі з них не розчиняються і у розведених кислотах. Тому такі сульфіди можна легко отримати, пропускаючи
сірководень через солі відповідного металу, наприклад:Деякі сульфіди мають характерне забарвлення:
CuSі PbS- чорну, CdS- жовту, ZnS- білу, MnS- рожеву, SnS- коричневу, Sb 2 S 3- помаранчеву і т. д. На різній розчинно c ти сульфідів та різного забарвлення багатьох з них заснований якісний аналіз катіонів.Оксид сірки (ІV). Оксид сірки (IV), або сірчистий газ, за звичайних умов – безбарвний газ із різким, задушливим запахом. При охолодженні до -10 ° С зріджується безбарвну рідину. У рідкому вигляді його зберігають у сталевих балонах.
утворюється при спалюванні сірки в кисні або при випаленні сульфідів. Він добре розчинний у воді (40 об'ємів у 1 об'ємі води при 20 °С).Отримання. В лабораторії оксид сірки (IV) одержують взаємодією гідросульфіту натрію із сірчаною кислотою:
а також нагріванням міді з концентрованою сірчаною кислотою:
Оксид сірки (IV) утворюється також при спалюванні сірки.
У промислових умовах S
O 2 одержують при випаленні піриту FeS 2 або сірчистих руд кольорових металів (цинкової обманки ZnS, свинцевого блиску PbS та ін.). оксид, Що Утворюється в цих умовахсірки (IV) SO 2 Використовується головним чином отримання оксиду сірки (VI) SO 3 та сірчаної кислоти. Структурна формула молекули S O 2:Як бачимо, у освіті зв'язків у молекулі S
O 2 беруть участь чотири електрони сірки та чотири електрони від двох атомів кисню. Взаємне відштовхування зв'язувальних електронних пар та неподіленої електронної пари атома сірки надає молекулі кутової форми.Оксид сірки
(IV) виявляє усі властивості кислотних оксидів.Сірчиста кислота.
Оксид сірки (IV) - ангідрид сірчистої кислоти H 2 SO 3 ,тому при розчиненні SO 2 у воді частково відбувається реакція з водою і утворюється слабка сірчиста кислота:яка малостійка, легко розпадається знову на
SO 2 та Н 2 О. У водному розчині сірчистого газу одночасно існують такі рівноваги:Константа дисоціації
H 2 SO 3 по першому ступені дорівнює K 1 = 1,6 Ч 10 -2по другій - K 2 = 6,3 Ч 10 -8. Будучи двоосновною кислотою, вона дає два ряди солей: середні - сульфітита кислі - гідросульфіти.Сульфіти утворюються при повній нейтралізації кислоти лугом:
Гідросульфіти виходять при нестачі лугу (порівняно з кількістю, необхідною для повної нейтралізації кислоти):
Як і оксид сірки (IV), сірчиста кислота та її солі є сильними відновниками. При цьому рівень окислення сірки зростає. Так, H
2 SO 3 легко окислюється в сірчану кислоту навіть киснем повітря:Тому розчини сірчистої кислоти, що довго зберігалися, завжди містять сірчану кислоту.
Ще легше протікає окислення сірчистої кислоти бромом та перманганатом калію:
Хімічні реакції, характерні для
SO 2 , сірчистої кислоти та її солей, можна розділити на три групи:1. Реакції, що протікають без зміни ступеня окиснення, наприклад:
Реакції, що супроводжуються підвищенням ступеня окиснення сірки від 4+ до 6+:3. Реакції, що протікають зі зниженням ступеня окислення сірки, наприклад, вже зазначена вище взаємодія
SO 2 з H 2 S.Таким чином,
SO 2 , сірчиста кислота та її солі можуть проявляти як окисні, так і відновлювальні властивості.Застосування. Оксид сірки (IV) та сірчиста кислота знебарвлюють багато барвників, утворюючи з ними безбарвні сполуки. Останні можуть знову розкладатися при нагріванні або світла, внаслідок чого забарвлення відновлюється. Отже, білить дію S
O 2 та H 2 SO 3 відрізняється від дії хлору, що білить. Зазвичай оксидом сірки (IV) білять шерсть, шовк та солому (хлорною водою ці матеріали руйнуються).Оксид сірки (IV) вбиває багато мікроорганізмів. Тому для знищення пліснявих грибків їм обкурюють сирі підвали, льохи, винні бочки та ін. Використовують також при перевезенні та зберіганні фруктів та ягід. У великих кількостях оксид сірки (IV) використовується для одержання сірчаної кислоти.
Важливе застосування знаходить розчин гідросульфіту кальцію Са(Н
SO 3) 2 (сульфітний луг), яким обробляють волокна деревини та паперову масу.Оксид сірки (
VI). SO 3 - ангідрид сірчаної кислоти - речовина з t пл = 16,8 ° С і t кіп = 44,8 ° С. Оксид сірки (VI), або триоксид сірки, - це безбарвна рідина, що твердне при температурі нижче 17 ° С у тверду кристалічну масу. Оксид сірки (VI) має всі властивості кислотних оксидів. Він є проміжним продуктомвиробництва сірчаної кислотиОксид сірки (VI) одержують окисленням
SO 2 киснем тільки у присутності каталізатора:Необхідність використання каталізатора у цій оборотній реакції обумовлена тим, що гарний вихід
SO 3 (тобто зсув рівноваги вправо) можна отримати тільки при зниженні температури, проте при низьких температурахдуже сильно падає швидкість протіканняреакції.Молекула
SO 3 має форму трикутника, в центрі якого знаходиться атом сірки:Така будова обумовлена взаємним відштовхуванням електронних пар, що зв'язують. На їхнє утворення атом сірки надав усі шість зовнішніх електронів.
Сірчана кислота.
Оксид сірки (VI) енергійно з'єднується з водою, утворюючи сірчану кислоту:![]()
Фізичні властивості. Сірчана кислота – важка безбарвна масляниста рідина. Вкрай гігроскопічна. Поглинає вологу з виділенням великої кількості теплоти, тому
не можна воду приливати до концентрованої кислоти - відбудеться розбризкування кислоти. Для розведеннятреба сірчану кислоту приливати невеликою кількістю до води.Безводна сірчана кислота розчиняє до 70% оксиду сірки (VI). При нормальній температурі вона не летюча і не має запаху. При нагріванні відщеплює SO 3 до тих пір, поки не утворюється розчин, що містить 98,3% Н 2 SO 4 . Безводна Н 2 SO 4 майже проводить електричний струм.
Хімічні властивості. Концентрована сірчана кислота обглинає органічні речовини - цукор, папір, дерево, волокна тат. д., забираючи від них елементи води. При цьому утворюються гідрати сірчаної кислоти. Обвуглювання цукру можна виразити рівнянням
Вугілля, що утворилося, частково вступає у взаємодію з кислотою:
Тому кислота, яка йде у продаж, має бурий колір від
пилу, що випадково потрапили і обвуглилися в ній, і органічних речовин.На поглинанні (відібранні) води сірчаною кислотою заснована осушка газів.
Як сильна нелетюча кислота
H 2 SO 4 витісняє інші кислоти із сухих солей:Однак якщо Н
2 SO 4 додається до розчинам солей , то витіснення кислот немає.При взаємодії концентрованоюсірчаної кислоти з різними металами, як правило, відбувається її відновлення до
SO 2:Концентрована
сірчана кислота окислює мідь, срібло, вуглець, фосфор: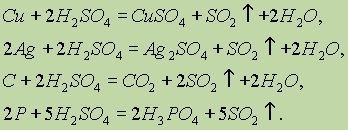
Розведена
сірчана кислота окислює тільки метали, що стоять у ряді напруг лівіше водню, за рахунок іонів Н + :З усіх сульфатів найменшу розчинність має сульфат барію - саме тому його утворення у вигляді білого осаду використовують як якісну реакцію на сульфат-іон:
Значення сірчаної кислоти.
Сірчана кислота є найважливішим продуктом основної хімічної промисловості, що займається виробництвом неорганічних кислот, лугів, солей мінеральних добрив та хлору.За різноманітністю застосування сірчана кислота посідає перше місце серед кислот. Найбільша кількістьїї витрачається для отримання фосфорних та азотних добрив. Будучи нелетючою кислотою, сірчана кислота використовується для отримання інших кислот - соляної, плавикової, фосфорної, оцтової і т. д. Багато її йде для очищення нафтопродуктів - бензину, гасу та мастил - від шкідливих домішок. У машинобудуванні сірчаною кислотою очищають поверхню металу від оксидів перед покриттям (нікелюванням, хромуванням та ін.). Сірчана кислота застосовується у виробництві вибухових речовин, штучного волокна, барвників, пластмас та багатьох інших. Її використовують для заливання акумуляторів. У сільське господарство вона використовується боротьби з бур'янами (гербіцид).
Солі сірчаної кислоти. Сірчана кислота, будучи двоосновною, утворює два ряди солей: середні, звані сульфатами, і кислі, звані гідросульфатами . Сульфати утворюються при повній нейтралізації кислоти лугом (на один моль кислоти припадає два моля лугу), а гідросульфати - при нестачі лугу (на один моль кислоти - один моль лугу):
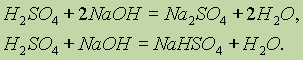
Багато солі сірчаної кислоти мають велике практичне значення.
Copyright © 2005-2013 Xenoid v2.0
Використання матеріалів сайту можливе за умови вказівки активного посилання
