2 Неметали – це хімічні елементи, атоми яких легко приймають електрони завершення зовнішнього енергетичного рівня, утворюючи у своїй негативно заряджені іони. Елементи-неметали розташовані в кінці періодів і мають електронну конфігурацію зовнішнього шару, близьку до конфігурації найближчого інертного газу або рівну їй. Практично всі неметали мають порівняно малі радіуси, для них характерні високі значенняелектронегативності та окисні властивості.
Наприклад, у разі заліза це частина білка, який називається гемоглобіном, який присутній в еритроцитах. Залізо відповідає за червоне фарбування, коли воно зв'язується із киснем. У природі багато металів є частиною різних кольорових сполук, де колір визначається їхньою присутністю. Властивості неметалів: неметали, на відміну від металів, не мають властивості ковкості, пластичності та їх здатності проводити тепло та електрику, загалом, дуже малі; Крім того, вони мають дуже низьку густину в порівнянні з металами.
Неметали, такі як вуглець, фосфор, сірка, селен та йод, є непрозорими та мають низьку щільність. Деякі неметали, такі як вуглець, азот, кисень, фосфор та сірка, мають велике значення для живих істот, оскільки вони становлять значну частину їхніх структур у вигляді білків, вуглеводів, ліпідів та інших.
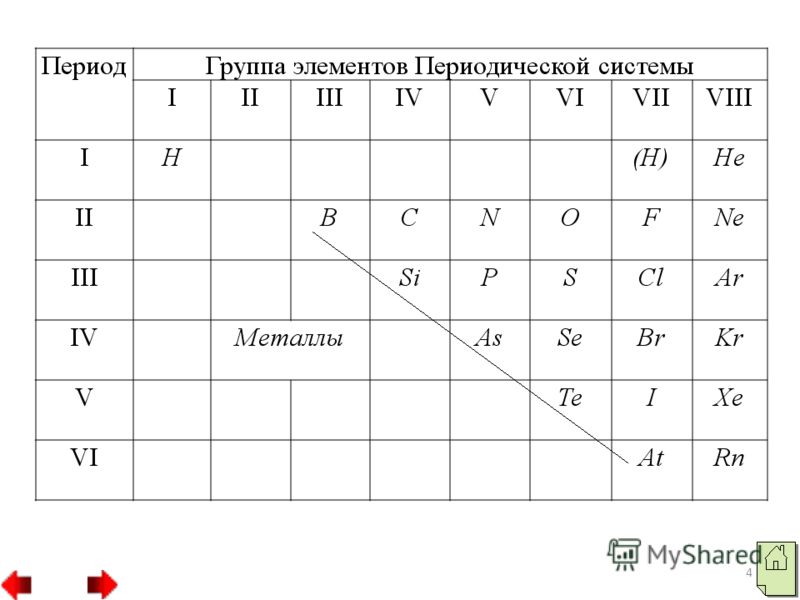
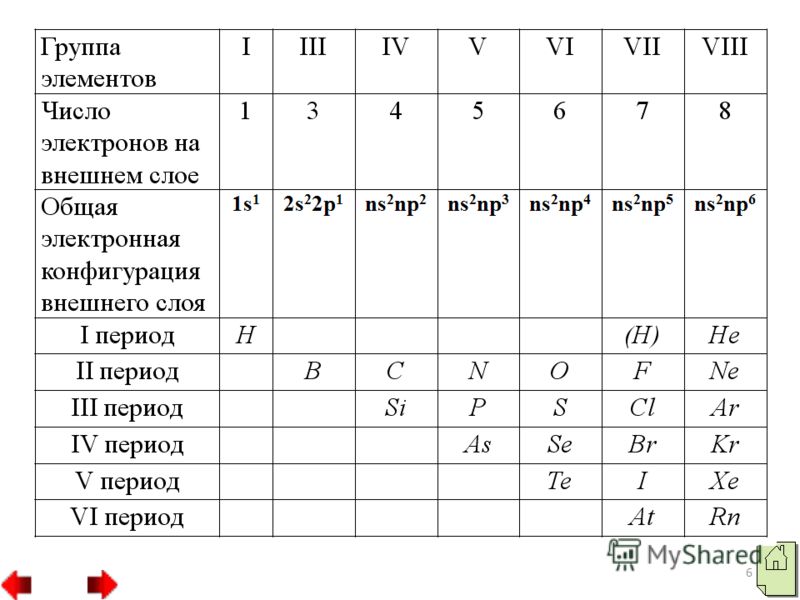
3 Серед неметалів два елементи водень і гелій відносяться до s-родини, всі інші належать до р-родини. На зовнішньому електронному шарі атоми неметалів знаходяться різна кількістьелектронів: у атома водню - один електрон (1s"), у атома гелію - два електрони, у атома бору три електрони. Проте атоми більшості неметалів, на відміну від атомів металів, на зовнішньому електронному шарі мають велику кількість електров від 4 до 8. Всі речовини-неметали утворені атомами, пов'язаними між собою ковалентною неполярним зв'язком. Вони можуть мати молекулярну будову, як молекули водню, кисню, азоту та ін або атомну будову, як кристали алмазу або бору.

4
5

6
7
8 Роль неметалів та його сполук у природі дуже велика. Неметали становлять понад 84% від маси ґрунту, 98,5% від маси рослин та 97,6% від маси тіла людини. Шість неметалів вуглець, водень, кисень, азот, фосфор та сірка є органогенними елементами, оскільки входять до складу молекул білків, жирів, вуглеводів та нуклеїнових кислот. Повітря, яким ми дихаємо, є сумішшю простих і складних речовин, утворених неметалами (кисень, азот, вуглекислий газ).

9

10 Речовини-неметали, що мають молекулярну будову, можуть перебувати в газоподібному, рідкому або твердому стані. Всі вони через слабкі міжмолекулярні сили мають низькі температури кипіння і плавлення. Речовини-неметали, що мають атомну будову, знаходяться тільки в твердому агрегатному стані, їх атоми пов'язані між собою міцними. ковалентними зв'язкамиі утворюють макромолекули, наприклад, n, S n, Si n. Зазвичай вони мають високу твердість, високі температури плавлення та кипіння. Багато неметалів здатні утворювати алотропні модифікації: O 2, O 3. Усі неметали погано проводять тепло та електричний струм. Кристали неметалів непластичні та крихкі. Більшість з неметалів немає металевого блиску.

11


13


15 Водневі сполуки неметалів характеризуються різним ставленням до води. Метан і силан у воді погано розчиняються. Аміак і фосфін при розчиненні у воді утворюють слабкі основи – гідроксид амонію NH 4 OH та гідроксид фосфонію РH 4 OH. При розчиненні у воді сірководню, селеноводу і телуроводню, а також галогенводнів утворюються кислоти тієї ж формули, що і самі водневі сполуки.

16 У періодах зліва направо кислотні властивості летких водневих сполук неметалів у водних розчинах посилюються, а групах слабшають. Окисна активність водневих сполук неметалів у групах зверху вниз сильно зменшується. HF HCl HBr HI



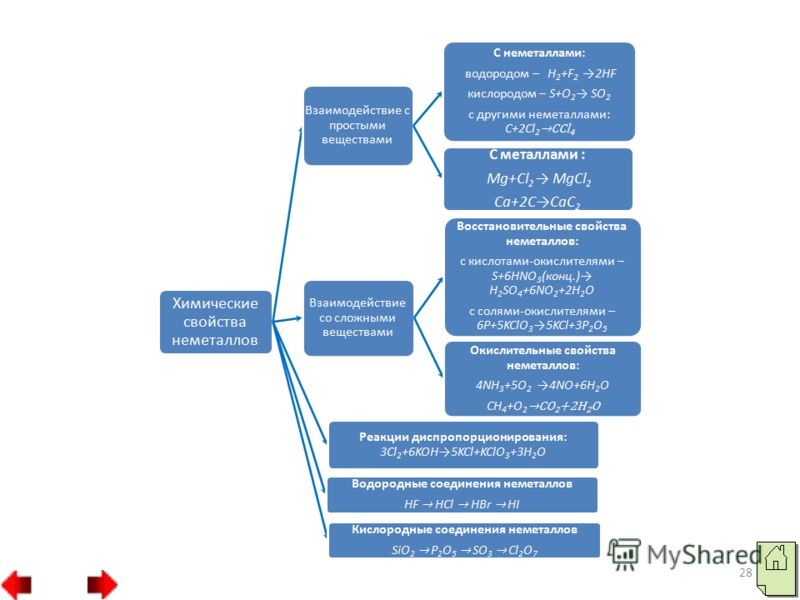
5. Не тільки кисень, а й інші неметали (фтор, йод, бром та інші) також можуть відігравати роль окислювача у реакціях зі складними речовинами. Наприклад, сильний окислювач хлор, окислює хлорид заліза (II) в хлорид заліза (III):

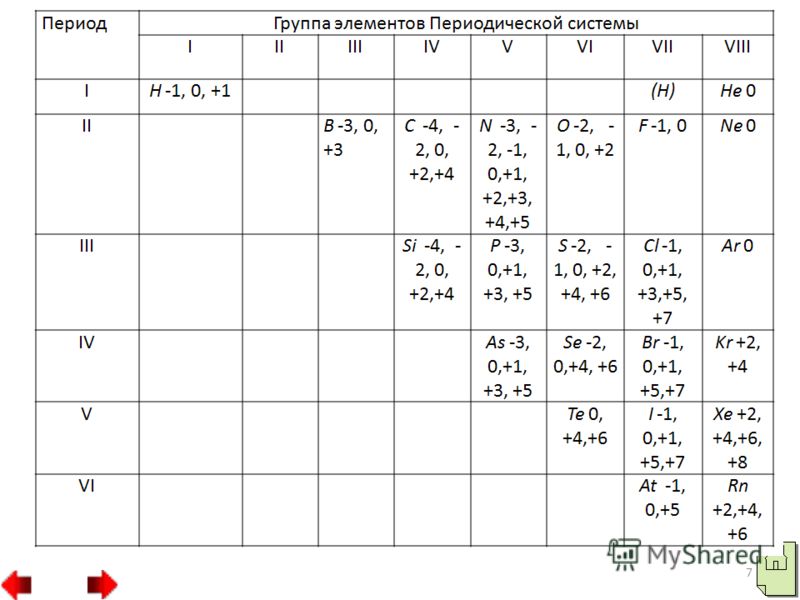
20 Слід наголосити, що неметали (крім фтору) можуть виявляти і відновлювальні властивості. При цьому електрони атомів неметалів змішаються до атомів елементів-окислювачів. У сполуках, що утворюються, атоми неметалів мають позитивні ступені окислення. Вища позитивна ступінь окиснення неметалу зазвичай дорівнює номеру групи. Відновлювальна активність неметалів:



23 3. Найбільш сильні відновлювальні властивості мають неметали вуглець і водень: Таким чином, практично всі неметали можуть виступати як у ролі окислювачів, так і ролі відновників. Це залежить від того, з якою речовиною взаємодіє неметал.

24 Реакції самоокислення-самовосстановления (диспропорціонування) - це такі реакції, в яких один і той неметал є одночасно і окислювачем, і відновником. Так диспропорціонує фосфор, сірка, селен, хлор у лужних середовищах: Неметали, що є нерозчинними у воді твердими сполуками з міцними кристалічними ґратами (вуглець, кремній) або погано розчинні у воді (кисень, водень), у реакціях диспропорціонування не беруть участі.

25 Оксиди неметалів поділяються на дві групи: несолетворні та солеутворюючі оксиди. До несолетворних оксидів відносяться: N 2 O, NO, CO. Решта оксидів неметалів є солеутворюючими. Солеутворюючі оксиди неметалів відносяться до кислотних оксидів. Серед них є газоподібні (CO2, SO2, NO2), рідкі речовини (SO3, N2O3) і тверді (P2O5, SiO2). Кислотні оксиди – це ангідриди кислот. Наприклад: CO 2 - ангідрид вугільної кислоти H 2 CO 3; P2O5 – ангідрид фосфорної кислоти H3PO4.

26 У головних підгрупах зверху вниз кислотні властивості вищих оксидів неметалів слабшають, а в періодах – зліва направо посилюються: SiO 2 P 2 O 5 SO 3 Cl 2 O 7 Посилення кислотних властивостей Усі кислотні оксиди, крім оксиду кремнію (II) SiO 2, розчиняються у воді, утворюючи гідрати оксидів, які за своїм характером є кислотами:

27
28


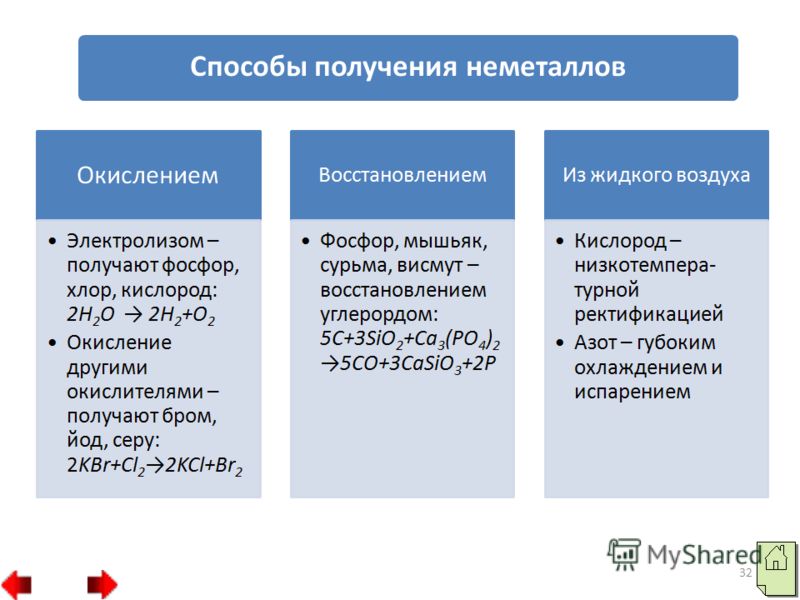
31 2. Деякі неметали можна отримати відновленням. Наприклад, фосфор, миш'як, сурму та вісмут отримують відновленням вуглецем: 3. Фізичні методи: а) низькотемпературна ректифікація - так одержують кисень з повітря; б) глибоке охолодження та випаровування – так одержують азот з повітря

32
33 Питання 1.У яких групах та періодах періодичної системи хімічних елементівД.І.Менделєєва зосереджені елементи-неметали? 2. Які неметали утворюють атомну кристалічну решітку, які – молекулярну та які знаходяться у вигляді окремих атомів? 3. Який з неметалів – рідкий при 20 °С, які неметали – гази та які – тверді речовини? 4. Як змінюються неметалеві характеристики елементів у таблиці Д.И.Менделеева у періодах зліва направо й у основних підгрупах зверху донизу?

34 5. Вкажіть, які елементи окислюються та які відновлюються у реакціях простих речовин: а) S + O 2 = SO 2; б) S + 2Cl 2 = SCl 4; в) Cl 2 + H 2 = 2HCl; г) 2P + 3Br 2 = 2PBr Деякі неметали взаємодіють з кислотами-окислювачами, перетворюючись на кислоти або кислотні оксиди з вищими ступенями окислення. Складіть рівняння наступних реакцій: а) С + Н 2 SО 4 (конц.) = б) С + НNО 3 (конц.) = в) S + НNО 3 (конц.) =

Будова та властивості простих речовин неметалів.
Найбільш типові неметали мають молекулярну будову, а менш типові немолекулярну. Цим і пояснюється відмінність їхніх властивостей. Наочно це відображено у схемі 2. Прості речовини з немолекулярною будовою з молекулярною будовою C, B, SiF2, O2, Cl2, Br2, N2, I2, S8У цих неметалів атомні кристалічні решітки, тому вони мають велику твердість і дуже високими температурамиплавлення. У цих неметалів у твердому стані молекулярні кристалічні грати.
При звичайних умовахце гази, рідини або тверді речовини з низькими температурамиплавлення. Таблиця 2 Кристалічний бір Як і кристалічний кремній володіє дуже високою температурою плавлення 2075С і великою твердістю. Електрична провідність бору з підвищенням температури сильно збільшується, що дає можливість широко застосовувати його напівпровідникової техніки. Добавка бору до сталі та сплавів алюмінію, міді, нікелю та ін. покращує їх механічні властивості.
Бориди з'єднання бору з деякими металами, наприклад титаном TiB, TiB2 необхідні при виготовленні деталей реактивних двигунів, лопаток газових турбін. Як видно зі схеми 2, вуглець С, кремній Si, бор мають подібну будову і володіють деякими загальними властивостями. Як прості речовини вони зустрічаються у двох видозмінах у кристалічному та аморфному. Кристалічні видозміни цих елементів є дуже твердими, з високими температурами плавлення. Кристалічний кремній має напівпровідникові властивості.
Всі ці елементи утворюють сполуки з металами карбіди, силіциди та бориди CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2. Деякі з них мають більшу твердість, наприклад Fe3C, TiB. Карбід кальцію використовується для одержання ацетилену. Якщо порівняти розташування електронів за орбіталями в атомах фтору, хлору та інших галогенів, то можна судити і про їх відмінні властивості. Атом фтору вільних орбіталей немає. Тому атоми фтору можуть виявити лише валентність I і ступінь окислення 1. В атомах інших галогенів, наприклад, в атомі хлору, на тому ж енергетичному рівні є вільні d-орбіталі.
Завдяки цьому розпарювання електронів може статися трьома різними шляхами. У першому випадку хлор може виявити ступінь окислення 3 і утворити хлористу кислоту HClO2, якою відповідають солі хлорити, наприклад, хлорит калію KClO2. У другому випадку хлор може утворити сполуки, в яких ступінь окислення хлору 5. До таких сполук відносяться хлорувата кислота HClO3 та її солі хлорати, наприклад хлорат калію КClO3 бертолетова сіль. У третьому випадку хлор виявляє ступінь окислення 7, наприклад, у хлорній кислоті HClO4 та в її солях перхлоратах, наприклад, у перхлораті калію КClO4. 4. Кисневі та водневі сполуки неметалів.
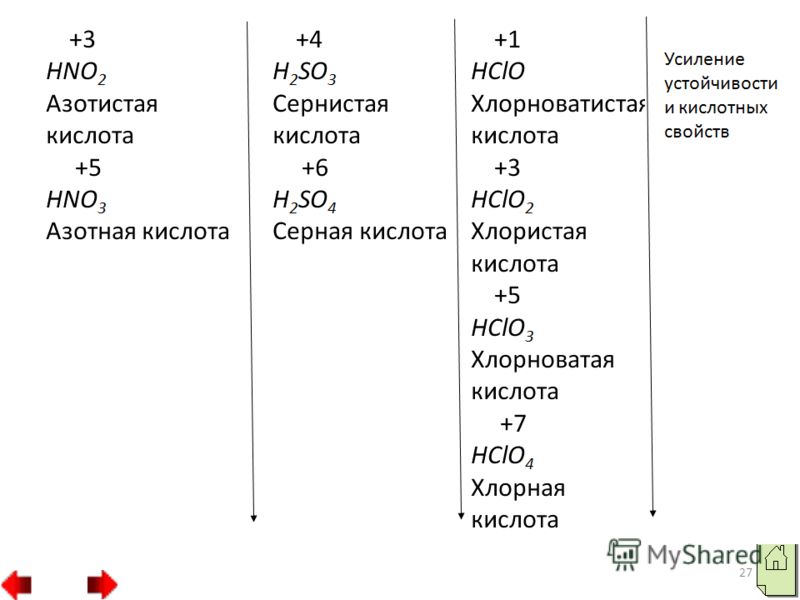
Коротка характеристика їх властивостей. З киснем неметали утворюють кислотні оксиди. В одних оксидах вони виявляють максимальний ступінь окислення, рівну номеру групи наприклад, SO2, N2O5, а інших нижчий наприклад, SO2, N2O3. Кислотним оксидам відповідають кислоти, причому з двох кисневих кислот одного неметалу сильніша за ту, в якій він виявляє більш високий ступінь окислення.
Наприклад, азотна кислота HNO3 сильніше азотистої HNO2, а сірчана кислота H2SO4 сильніше сірчистої H2SO3. Показники кисневих сполук неметалів 1. Властивості вищих оксидів тобто. оксидів, до складу яких входить елемент даної групи з найвищим ступенемокислення в періодах зліва направо поступово змінюються від основних до кислотних. 2. У групах зверху донизу кислотні властивості вищих оксидів поступово слабшають.
Про це можна судити з властивостей кислот, що відповідають цим оксидам. 3. Зростання кислотних властивостей вищих оксидів відповідних елементів у періодах зліва направо пояснюється поступовим зростанням позитивного зарядуіонів цих елементів. 4. У основних підгрупах періодичної системи хімічних елементів у бік зверху донизу кислотні властивості вищих оксидів неметалів зменшуються.
Загальні формули водневих сполук за групами періодичної системи хімічних елементів наведені в таблиці 3. Загальні формули сполук за групами IVVVIVIIRHRH2RH3RH4RH3H2RHRНелеткі водневі сполукиЛетючі водневі сполукиТаблиця 3. З металами водень утворює деякі речовини. Тому їх температури плавлення порівняно високі.
З неметалами водень утворює леткі сполуки молекулярної будови. У звичайних умовах це гази чи леткі рідини. У періодах ліворуч кислотні властивості летких водневих сполук неметалів у водних розчинах посилюється. Це тим, що іони кисню мають вільні електронні пари, а іони водню вільну орбіталь, відбувається процес, який виглядає так H2O HF H3O F Фтороводород у водному розчині відщеплює позитивні іони водню, тобто. виявляє кислотні властивості.
Цьому процесу сприяє й інша обставина іон кисню має неподілену електронну пару, а іон водню - вільну орбіталь, завдяки чому утворюється донорно-акцепторний зв'язок. При розчиненні аміаку у питній воді відбувається протилежний процес. Оскільки іони азоту мають неподілену електронну пару, а іони водню вільну орбіталь, виникає додатковий зв'язок і утворюються іони амонію NH4 і гідроксид-іони ВІН В результаті розчин набуває основних властивостей.
Цей процес можна виразити формулою H2O NH3 NH4 OH Молекули аміаку водному розчині приєднують позитивні іони водню, тобто. аміак виявляє основні властивості. Тепер розглянемо, чому водневе з'єднанняфтору фтороводород HF у водному розчині є кислотою, але слабшою, ніж хлороводнева. Це тим, що радіуси іонів фтору значно менше, ніж іонів хлору. Тому іони фтору набагато сильніше притягують себе іони водню, ніж іони хлору.
У зв'язку з цим рівень дисоціації фтороводородной кислоти значно менше, ніж соляної кислоти, тобто. фтороводородна кислота слабша за соляну кислоту. З наведених прикладів можна зробити такі загальні
Кінець роботи -
Ця тема належить розділу:
Неметали
У різні історичні епохи у поняття елемент вкладався різний зміст. Давньогрецькі філософи як елементи розглядали чотири… У середні віки до цих початків додалися сіль, сірка та ртуть. У XVII столітті Р.… Згодом з'ясувалося, що до таблиці увійшли деякі складні речовини. В даний час поняття хімічний.
Якщо Вам потрібний додатковий матеріал на цю тему, або Ви не знайшли те, що шукали, рекомендуємо скористатися пошуком по нашій базі робіт:
Що робитимемо з отриманим матеріалом:
Якщо цей матеріал виявився корисним для Вас, Ви можете зберегти його на свою сторінку в соціальних мережах:
