Будова та фізичні властивості воднюВодень - двоатомний газ Н2. Він не має ні кольору, ні запаху. Це найлегший газ. Завдяки цій властивості він використовувався в аеростатах, дирижаблях і тому подібних пристроях, проте широкому застосуванню водню з цією метою заважає його вибухонебезпечність у суміші з повітрям.
Молекули водню неполярні і дуже малі, тому взаємодія між ними мало. У зв'язку з цим він має дуже низькі температуриплавлення (-259оС) та кипіння (-253оС). Водень практично нерозчинний у воді.
Водень має 3 ізотопи: звичайний 1Н, дейтерій 2H або D, і радіоактивний тритій 3Н або Т. Важкі ізотопи водню унікальні тим, що важче за звичайний водень у 2 або навіть у 3 рази! Саме тому заміна звичайного водню на дейтерій або тритій помітно позначається на властивостях речовини (так температури кипіння звичайного водню Н2 і дейтерію D2 різняться на 3,2 градуси). Взаємодія водню з простими речовинами Водень - неметал середньої електронегативності. Тому йому притаманні і окисні, і відновлювальні властивості.
Окисні властивості водню проявляються у реакціях з типовими металами - елементами головних підгруп I-II групи таблиці Менделєєва. Найактивніші метали (лужні та лужноземельні) при нагріванні з воднем дають гідриди – тверді солеподібні речовини, що містять у кристалічній решітці гідрид-іон Н-. 2Na + Н2 = 2NaН ; Са + Н2 = СаН2Відновлювальні властивості водню проявляються в реакціях з типовими неметалами, ніж водень: 1) Взаємодія з галогенами H2 + F2 = 2HF
Аналогічно протікає взаємодія з аналогами фтору – хлором, бромом, йодом. У міру зменшення активності галогену інтенсивність перебігу реакції зменшується. Реакція з фтором відбувається при звичайних умовахз вибухом, реакції з хлором потрібно освітлення чи нагрівання, а реакція з йодом протікає лише за сильному нагріванні і оборотно. 2) Взаємодія з киснем 2Н2 + О2 = 2Н2О Реакція протікає з великим виділенням тепла, іноді вибухом. 3) Взаємодія із сіркоюН2 + S = H2S Сірка - набагато менш активний неметал, ніж кисень, і взаємодія з воднем протікає спокійно. 4) Взаємодія з азотом 3Н2 + N2↔ 2NH3 Реакція оборотна, протікає в помітній мірі тільки у присутності каталізатора, при нагріванні та під тиском. Продукт називається аміак. 5) Взаємодія з вуглецемС + 2Н2↔ СН4 Реакція протікає в електричній дузі або за дуже високих температур. Як побічні продукти утворюються й інші вуглеводні. 3. Взаємодія водню зі складними речовинамиВодень виявляє відновлювальні властивості і в реакціях зі складними речовинами: 1) Відновлення оксидів металів, що стоять в електрохімічному ряду напруг правіше алюмінію, а також оксиди неметалів: Fe2O3 + 2H2 2Fe + 3H2O ; CuO + H2 Cu + H2O Водень застосовують як відновник для вилучення металів із оксидних руд. Реакції йдуть при нагріванні.2) Приєднання до органічних ненасичених речовин; С2Н4 + Н2(t;p)→ С2Н6 Реакції протікають у присутності каталізатора та під тиском. Інших реакцій водню ми поки що не торкатимемося. 4. Одержання воднюУ промисловості водень отримують переробкою вуглеводневої сировини - природного та попутного газу, коксу тощо. Лабораторні методи одержання водню:
1) Взаємодія металів, що стоять в електрохімічному ряду напруг металів лівіше водню, з кислотами. Взаємодія металів, що стоять в електрохімічному ряду напруг металів ліворуч від магнію, з холодною водою. При цьому також утворюється луг.
2Na + 2H2O = 2NaOH + H2 Метал, що знаходиться в електрохімічному ряді напруг металів лівіше за марганець, здатний витісняти водень з води за певних умов (магній - з гарячої води, алюміній - за умови зняття оксидної плівки з поверхні).
Mg + 2H2O Mg(OH)2 + H2
Метал, що знаходиться в електрохімічному ряду напруг металів лівіше за кобальт, здатний витісняти водень з водяної пари. При цьому утворюється також оксид.
3Fe + 4H2Oпар Fe3O4 + 4H23) Взаємодія металів, гідроксиди яких амфотерні, з розчинами лугів.
Метали, гідроксиди яких амфотерни, витісняють водень із розчинів лугів. Вам необхідно знати 2 таких метали - алюміній та цинк:
2Al + 2NaOH +6H2O = 2Na + + 3H2
Zn + 2KOH + 2H2O = K2 + H2
При цьому утворюються комплексні солі - гідроксоалюмінати та гідроксоцінкати.
Усі методи, перераховані досі, засновані на тому самому процесі - окисленні металу атомом водню в ступені окислення +1:
М0 + nН + = Мn + + n/2 H2
4) Взаємодія гідридів активних металів із водою:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2
Цей процес заснований на взаємодії водню у ступені окислення -1 з воднем у ступені окислення +1:
5) Електроліз водних розчинів лугів, кислот, деяких солей:
2Н2О 2Н2 + О2
5. Водневі сполуки У цій таблиці зліва легкою тінню виділено клітини елементів, що утворюють з воднем іонні сполуки - гідриди. Ці речовини мають у своєму складі гідрид-іон Н-. Вони є твердими безбарвними солеподібними речовинами і реагують з водою з виділенням водню.
Елементи основних підгруп IV-VII груп утворюють з воднем сполуки молекулярної будови. Іноді їх називають гідридами, але це некоректно. У їхньому складі немає гідрид-іону, вони складаються з молекул. Як правило, найпростіші водневі сполуки цих елементів – безбарвні гази. Винятки - вода, що є рідиною, та фтороводород, який за кімнатної температури газоподібний, але за нормальних умов - рідина.
Темними клітинами відзначені елементи, що утворюють з воднем сполуки, що виявляють кислотні властивості.
Темними клітинами з хрестом позначені елементи, що утворюють з воднем сполуки, які виявляють основні властивості.
=================================================================================
29). загальна характеристика властивостей елементів головної підгрупи 7гр. Хлор. Властивості Лора. Соляної кислоти.У підгрупу галогенів входять фтор, хлор, бром, йод та астат (астат – радіоактивний елемент, вивчений мало). Це р-елементи VII групи періодичної системи Д.І.Менделєєва. На зовнішньому енергетичному рівні їх атоми мають 7 електронів ns2np5. Цим пояснюється спільність їх властивостей.
Вони легко приєднують по одному електрону, виявляючи ступінь окиснення -1. Такий ступінь окислення галогени мають у сполуках з воднем та металами.
Однак атоми галогенів, крім фтору, можуть виявляти і позитивні ступені окислення: +1, +3, +5, +7. Можливі значення ступенів окислення пояснюються електронною будовою, яку у атомів фтору можна представити схемою
Будучи найбільш електронегативним елементом, фтор може тільки приймати один електрон на 2р під рівень. У нього один неспарений електрон, тому фтор буває тільки одновалентним, а ступінь окислення завжди -1.
Електронна будова атома хлору виражається схемою атома хлору один неспарений електрон на 3р-підрівні і звичайному (незбудженому) стані хлор одновалентний. Але оскільки хлор знаходиться в третьому періоді, то він має ще п'ять орбіталей 3d-підрівня, в яких можуть розміститися 10 електронів.
У фтору немає вільних орбіталей, отже, при хімічних реакціях немає роз'єднання спарених електронів в атомі. Тому при розгляді властивостей галогенів завжди треба враховувати особливості фтору та сполук.
Водні розчини водневих сполук галогенів є кислотами: НF – фтороводнева (плавикова), НСl – хлороводнева (соляна), НВr – бромводнева, НI – йодоводнева.
Хлор (лат. Chlorum), Cl, хімічний елемент VII групи періодичної системи Менделєєва, атомний номер 17, атомна маса 35453; відноситься до сімейства галогенів. За нормальних умов (0°С, 0,1 Мн/м2, або 1 кгс/см2) жовто-зелений газ із різким подразнюючим запахом. Природний хлор складається з двох стабільних ізотопів: 35Сl (75,77%) та 37Cl (24,23%).
Хімічні властивості хлору. Зовнішня електронна конфігурація атома Cl3s2Зр5. Відповідно до цього Хлор у сполуках виявляє ступені окислення -1, +1, +3, +4, +5, +6 та +7. Ковалентний радіус атома 0,99 Å, іонний радіус Cl-1.82 Å, спорідненість атома Хлору до електрона 3,65 ев, енергія іонізації 12,97 ев.
Хімічно Хлор дуже активний, безпосередньо з'єднується майже з усіма металами (з деякими тільки у присутності вологи або при нагріванні) та з неметалами (крім вуглецю, азоту, кисню, інертних газів), утворюючи відповідні хлориди, вступає в реакцію з багатьма сполуками, заміщає у граничних вуглеводнях і приєднується до ненасичених сполук. Хлор витісняє бром та йод з їх сполук з воднем та металами; зі сполук Хлора із цими елементами він витісняється фтором. Лужні метали у присутності слідів вологи взаємодіють з Хлором із запаленням, більшість металів реагує із сухим Хлором тільки при нагріванні Фосфор займається в атмосфері Хлору, утворюючи РCl3, а при подальшому хлоруванні – РСl5; сірка з хлором при нагріванні дає S2Cl2, SCl2 та інші SnClm. Миш'як, сурма, вісмут, стронцій, телур енергійно взаємодіють із Хлором. Суміш Хлора з воднем горить безбарвним чи жовто-зеленим полум'ям із заснуванням хлористого водню (це ланцюгова реакція). З киснем Хлор утворює оксиди: Cl2О, СlO2, Cl2О6, Сl2О7, Cl2О8, а також гіпохлорити (солі хлорнуватистої кислоти), хлорити, хлорати та перхлорати. Всі кисневі сполуки хлору утворюють вибухонебезпечні суміші з речовинами, що легко окислюються. Хлор у воді гідролізується, утворюючи хлорнувату та соляну кислоти: Cl2 + Н2О = НClО + НCl. При хлоруванні водних розчинів лугів нахолоду утворюються гіпохлорити та хлориди: 2NaOH + Cl2 = NaClO + NaCl + Н2О, а при нагріванні - хлорати. Хлоруванням сухого гідрооксиду кальцію отримують хлорне вапно. При взаємодії аміаку з хлором утворюється трихлористий азот. При хлоруванні органічних сполук Хлор або заміщає водень, або приєднується по кратних зв'язках, утворюючи різні органічні сполуки, що містять хлор. Хлор утворює з іншими галогенами міжгалогенні сполуки. Фториди ClF, ClF3, ClF3 дуже реакційноздатні; наприклад, в атмосфері ClF3 скляна вата самозаймається. Відомі сполуки хлору з киснем та фтором - оксифториди Хлору: ClO3F, ClO2F3, ClOF, ClOF3 та перхлорат фтору FClO4. Соляна кислота (хлороводнева, хлористоводнева, хлористий водень) - HCl, розчин хлороводню у воді; сильна одноосновна кислота. Безбарвна (технічна соляна кислота жовта з-за домішок Fe, Cl2 та ін.), «димна» на повітрі, їдка рідина. Максимальна концентрація при 20 °C дорівнює 38% за масою. Солі соляної кислоти називаються хлоридами.
Автор Хімічна енциклопедія р.н. І.Л.КнунянцГІДРИДИ, з'єднання водню з металами або менш електронегативними, ніж водень, неметалами Іноді до гідридів відносять з'єднання всіх хімічних елементів з воднем. Розрізняють прості, або бінарні, ГІДРИДИ, комплексні (див., наприклад, Алюмогідриди, Борогідриди металів) та ГІДРИДИ інтерметаллич. з'єднань. Для більшості перехідних металів відомі також комплексні з'єднання, Що містять атом Н поряд з ін. лігандами в координації. сфері металу-комплексоутворювача.
Прості гідриди.Відомі всім елементів, крім благородних газів, платинових металів (виняток -Pd), Ag, Au, Cd, Hg, In, Tl. Залежно від природи зв'язку елемента (Е) з воднем поділяються на ковалентні, іонні (солоподібні) та металоподібні (металеві), проте ця класифікація умовна, тому що між різними типами простих ГІДРИДИ різких меж немає.
До ковалентних відносять гідриди неметалів, Al, Be, Sn, Sb. Гідриди SiH 4 , GeH 4 , SnH 4 , PH 3 , AsH 3 , SbH 3 , H 2 S, H 2 Se, H 2 Te (див. табл. 1) та нижчі бороводні-гази. Ковалентні гідриди мають високу реакційну здатність. Ефективний покладе. заряд атома Е в молекулі зростає у межах однієї групи періодичної системи зі збільшенням його порядкового номера. Елементи Si та Ge утворюють вищі ГІДРИДИ загальної формули Е n Н 2n + 2 (п2), стабільність яких швидко зменшується зі збільшенням числа атомів Е. Гідриди елементів підгрупи S добре розчиняються у воді (розчини мають кислу реакцію), підгрупи Р-незначно. ГІДРИДИ елементів підгрупи Si взаємодія з водою з утворенням ЕО 2 та Н 2 . Всі ці гідриди розчиняються в неполярних або малополярних органічних розчинниках. Ковалентні гідриди-сильні відновники. Легко вступають в обмінні реакції, наприклад, з галогенідами металів. При 100-300 ° С (H 2 S близько 400 ° С) розкладаються практично незворотно до Е і Н 2 .
Табл. 1.-ВЛАСТИВОСТІ ПРОСТИХ КОВАЛЕНТНИХ І ІОННИХ ГІДРИДІВ 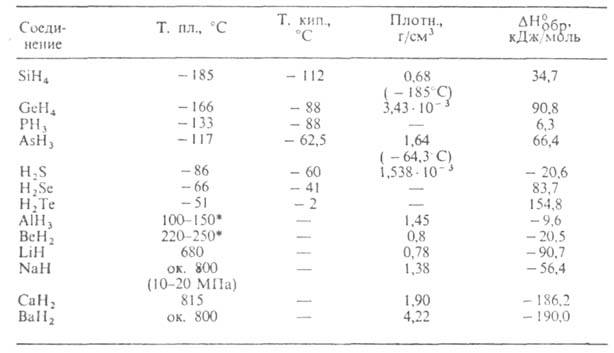
* Т-ра розкладання. ГІДРИДИ підгрупи фосфору отримують реакцією ЕCl 3 Li в ефірі при 25 °С; SiH 4 і GeH 4 -взаємодія Мg 2 Е з водою або з 2 Н 6 в рідкому NH 3 ; H 2 S, H 2 Se і Н 2 Те-кислотним гідролізом сульфідів, селенідів або телуридів металів (H 2 S-також взаємодія Н, і S). Всі згадані Р., особливо AsH 3 і РН 3 високотоксичні. Гідриди Ge, Si, As використовують для одержання напівпровідникових матеріалів. також Миш'яку гідрид, Сірководень, Силани, Фосфіни.
Гіриди ВеН 2 і AlН 3 , що існують у полімерному стані, а також вкрай нестійкий термічно Ga 2 H 6 за природою хімічною зв'язку Е-Нблизькі до бороводнів: для них характерний дефіцит електронів, у зв'язку з чим утворення молекул або кристалів відбувається за участю двоелектронних трицентрових місткових (Е-Н-Е) та багатоцентрових зв'язків. Для цих гідридів характерні дуже високі ентальпії згоряння. Вони взаємодіють з водою, виділяючи Н 2 . З донорами електронів, наприклад з NR 3 , PR 3 , утворюють адукти, з В 2 Н 6 в середовищі апротонних органічних розчинників-відповідно Аl[ВН 4 ] 3 і Ве [ВН 4 ] 2 . Отримують гідриди Al та Be за реакціями: 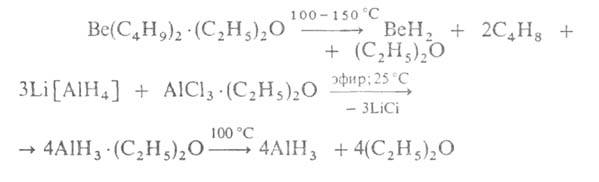
До іонних відносять ГІДРИДИ лужних та щел.-зем. металів (крім Mg). Ці сполуки є структурними аналогами відповідних галогенідів. Є кристалами, які розплавляються. стані проводять електрич. ток, причому Н 2 виділяється на аноді. Не розчинний в органічних розчинниках, добре розчинний у розплавах галогенідів лужних металів. Мають високу хімічну активність, бурхливо реагують з О 2 і вологою повітря. Взаємод. з водою (наприклад, МН + Н 2 Про -> МОН + Н 2) супроводжується виділенням тепла. В ефірі, диглімі, ТГФ легко (особливо LiH і NaH) реагують з галогенідами або гідридами і Al, утворюючи відповідно борогідриди М[ВН 4 ] n і алюмогідриди М n . При 700-800°З відновлюють оксиди до металів. З 2 дають солі мурашиної кислоти. Взаємод. з N 2, наприклад 3СаН 2 + + N 2 -> Ca 3 N 2 + ДН 2 .
Отримують іонні гідриди зазвичай взаємодія Н 2 з розплавом відповідного металу під тиском. Їх використовують як сильні відновники (наприклад, для отримання металів з їх оксидів або галогенідів, видалення окалини з поверхонь виробів зі сталі та тугоплавких металів). Багато ГІДРИДИ-джерела Н2, перспективне ракетне паливо. Дейтериди та тритієгідриди - можливе пальне для ядерних реакторів. також Літію гідрид.
Гідрид Mg за властивостями та природою хімічного зв'язку займає проміжні положення між ковалентними та іонними ГІДРИДИ; кристали з ґратами типу ТіО 2; при високих тисках (~ 7 МПа) зазнає поліморфних перетворень. З водою і водними розчинами кислот і лугів MgH 2 взаємодія з виділенням Н 2 проте менш енергійно, ніж ГІДРИДИ лужних та ін. щел.-зем. металів. М. б. отримано взаємодію Mg з Н 2 при 200-250 °З тиском 10 МПа (швидкість реакції мала) або обмінною реакцією MgHal 2 з МН або М , де М-Li, Na, в середовищі органічний розчинник. Легко утворюється при гідруванні сплавів Mg, що містять невеликі добавки РЗЕ і перехідних металів, при 150-180°З 1-5 МПа, причому оборотна реакція. У зв'язку з цим такі сплави-перспективні хімічні акумулятори Н 2 для потреб малої енергетики, металургії та хімічної технології.
До металоподібних відносять ГІДРИДИ перехідних металів та РЗЕ. Формально такі сполуки можна як фази впровадження водню в метал. Їхньому освіті завжди передує адсорбція Н 2 на поверхні металу.
Адсорбована молекула дисоціює на атоми Н, в результаті дифузії яких кристалічно. грати відбувається утворення т.зв.розчину водню в металі; процес не супроводжується перебудовою кристаліч. грати. При досягненні певної концентрації Н 2 у розчині утворюється власне ГІДРИДИ металу, як правило, стехіометрич. складу (МН 3 для металів III гр., МН 2 для IV гр. І ванадія). Взаємод. Н 2 із зазначеними металами (крім Pd) завжди супроводжується перебудовою кристаліч. грати. Для опису природи хімічного зв'язку водню з метал. матрицею використовують уявлення про тип зв'язку, проміжному між іонною та металевою; Електрони водню більшою чи меншою мірою беруть участь у формуванні зони провідності ГІДРИДИ Очевидно, внесок іонної складової зв'язку М+-Н-Наіб. великий для EuH 2 YbH 2 і тригідридів лантаноїдів і мінімальний для PdH 0,6 а також для гідридів Mn, Fe, Co, Ni, що існують при високих тисках Н 2 і містять менше одного атома Н на атом металу.
Металоподібні ГІДРИДИ (див. табл. 2)-світло- та темно-сірі кристали з металлич. блиском, стійкі на повітрі за кімнатної температури. З О 2 водою і водяною парою реагують повільно. М.Б. отримано взаємодію металу з Н 2 при звичайній температурі або при нагріванні; наприклад, TiH 2 та LaH 3 синтезують при 150-200 °С. Отримання ГІДРИДИ стехіометрич. складу в більшості випадків пов'язано зі значною труднощами через високу чутливість гідрування до наявності домішок в металі і особливо О 2 і водяної пари в Н 2 . Металоподібні ГІДРИДИ обмежено застосовують як джерела Н 2 високої чистоти (використовуються, наприклад, в паливних елементах) і для поглинання Н 2 з газових сумішей. Гідриди Pd-каталізатори гідрування, ізомеризації, орто- та параперетворення Н 2 .
Табл. 2.-ВЛАСТИВОСТІ МЕТАЛОподібних гідридів 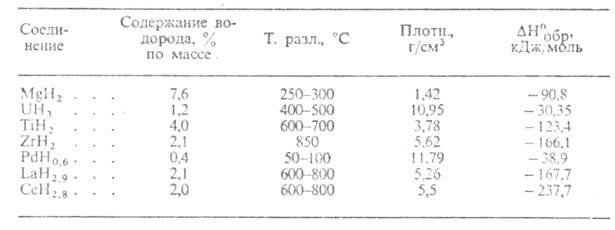
Гідриди інтерметалевих сполук.Містять зазвичай атоми РЗЕ, Mg, Ca, Ti, Al, Fe, Co, Ni, Сі. Легко утворюються при взаємодії інтерметалідів навіть із техн. Н 2 (містить до 1-2% домішок Про 2 і водяної пари) при 25-200°З тисками Н 2 0,1-1 МПа; швидкість поглинання Н2 дуже велика. Реакції характеризуються малими тепловими ефектами (20-30 кДж на 1 моль Н 2 для індивідуальних металів-100-120 кДж) і не призводять до значних зміну структурі вихідної металлич. матриці; здебільшого відбувається лише збільшення її обсягу на 10-30%. Для ГІДРИДИ цього характерна висока рухливість водню і більша хімічна активність (про властивості див. також табл. 3).
При 200-500 ° С і тиску Н 2 10 4 -10 5 Па відбувається гідрогеноліз інтерметалідів: мн х + м»н у<- мм» n + н 2 ->мн х + пМ»
Дана реакція характерна для з'єднання, утворених РЗЕ та Mg, а також РЗЕ та Fe, Ni або Со. Так, гідрид РЗЕ, що утворюється при гідрогеноліз інтерметаліду, що містить Mg, каталізує як гідрування Mg, так і дегідрування MgH 2 при 150-180°С: МН 2 + nMg + (n + 0,5) Н 2 МН 3 + nMgH 2
Завдяки високому вмісту Н 2 можливості значної зміщення рівноваги в ту чи іншу сторону за допомогою невеликих змін температури і тиску Н 2 здатності поглинати Н 2 при низьких температурах і стійкості до дії О 2 і вологи повітря, ГІДРИДИ інтерметаллич. сполук може бути використаний як хімічний акумулятори слабозв'язаного водню. Перспективне їх застосування як джерела палива для автономних енергосистем, наприклад автомобільного транспорту(Див. Воднева енергетика), а також для отримання високодисперсних металлич. порошків та каталізаторів гетеріг. гідрування.
Табл. 3.-ВЛАСТИВОСТІ ГІДРИДІВ ІНТЕРМЕТАЛІЧНИХ СПОЛУКІВ 
Хімічна енциклопедія Том 1 >>
Гідриди– це сполуки елементів із воднем. Всі гідриди можна розділити на чотири типи: три з яких утворені елементами головних підгруп, а один – елементами d.
1. Іонні(або солеподібні гідриди) – це речовини, утворені лужними та лужноземельними металами (наприклад, NaH, CaH 2). Ступінь окислення атома водню в іонних гідридах дорівнює -1.
Іонні гідриди є білими кристалічними речовинами з високими температурами плавлення. Кристалічні грати близькі до іонної (типу NaCl). Прим. Зі збільшенням розміру катіону зменшується енергія кристалічних ґрат, а значить і термічна стійкість гідридів. Наприклад, LiH плавиться без розкладання, а CsH розкладається за 170 ºС.
Іонні гідриди при розтиранні повітря самозаймисті:
Вони легко взаємодіють водою.
У хімічному відношенні іонні гідриди – це основні сполуки (при гідролізі утворюють луг). Стандартний електродний потенціал переходу 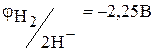 . Тому за рахунок іона іонні гідриди є сильними відновниками. Вони широко застосовуються щодо різних синтезів, щоб одержати водню й у хімічному аналізі. Гідрид кальцію використовується як осушувач для видалення слідів вологи.
. Тому за рахунок іона іонні гідриди є сильними відновниками. Вони широко застосовуються щодо різних синтезів, щоб одержати водню й у хімічному аналізі. Гідрид кальцію використовується як осушувач для видалення слідів вологи.
2. Ковалентні гідриди- Це речовини, утворені неметалами IV - VII груп основних підгруп. У ковалентних гідридах хімічний зв'язок ковалентний полярний, але може бути майже ковалентним неполярним (наприклад, РН 3), кристалічні грати молекулярні, низькі температури плавлення та кипіння. Ковалентні гідриди можуть бути байдужими (CH 4), основними (NH 3), кислотними (HCl, HF).
3. Полімерні гідридиіснують у вигляді складних структур з ланцюгами та поліедрами. Їх утворюють берилій, магній, елементи ІІІ групи головної підгрупи – бір, алюміній, галій. У звичайному стані речовини тверді. Стійкі до дії води та розведених кислот.
Водень виявляє полімерних гідридах ступінь окислення –1. Найбільш вивчений полімерний гідрид алюмінію (AlH 3) n . Полімеризація відбувається за рахунок утворення трицентрових зв'язків.
4. Металеві гідриди- Це речовини, утворені перехідними d і f елементами. Мають власну кристалічну будову і властивості, типові для металів: металевий блиск, твердість. Багато хто є жароміцними та корозійностійкими речовинами. Склад металевих гідридом не відповідає ступеню окиснення (MeH, MeH 2 , MeH 3). Нестехіометричні сполуки.
У самому металі водень може у різних станах: може утворювати твердий розчин, тобто атоми водню впроваджуються в кристалічну решітку металу, займаючи порожнечі, але з утворює із нею хімічні зв'язку. Так, один обсяг платини здатний поглинути 100 об'ємів водню, а один об'єм паладію – до 900.
З деякими металами водень утворює сполуки впровадження, проникає в кристалічну решітку між атомами металу та утворює ковалентні зв'язки. При малій кількості таких зв'язків зберігається металевий зв'язок та фізичні властивості металу. При великій кількості ковалентних зв'язків кристалічні грати металу перетворюються на грати іншого типу. З'являється крихкість (воднева крихкість металу).
ПИТАННЯ №29
У табличці зібрані деякі найпростіші водневі сполуки (гідриди) неметалів:
Фізичні властивості гідридів в цілому змінюються закономірно в межах кожної групи: чим нижче стоїть неметал, тим вища температура кипіння його гідриду і тим легше можна перетворити газоподібний гідрид на рідину.
Однак поведінка аміаку, води та фтористого водню порушує загальну логіку: температура кипіння та плавлення цих сполук аномально висока.
Справа в тому, що їх молекули асоційовані і не відповідають їх найпростішій формулі. Так, навіть у киплячому фтористому водні (+20°) середній склад його відповідає формулі (HF) 4 і лише за 90° пари складаються з молекул HF. Аналогічно, хоч і меншою мірою, асоційовані молекули рідкого аміаку. Вода у звичайних умовах, крім найпростіших молекул Н 2 О, містить молекули (Н 2 O) 2 , (Н 2 O) 3 ...
Зв'язок між молекулами води в таких подвійних і потрійних молекулярних агрегатах через її відносну міцність не можна пояснити лише звичайною орієнтацією диполів.
Як відбувається така асоціація молекул?
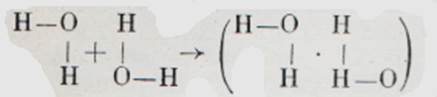
Щоб це було ясно, пригадаємо, що кожна валентна рисочка символізує загальну пару електронів пов'язаних ковалентно атомів. Крім того, атом кисню має і «вільну», що тільки йому належить пару електронів. Тому атом водню може зв'язатися як зі «своїм» атомом кисню, а й «чужим». Щоправда, такий зв'язок менш міцний, ніж звичайний ковалентний зв'язок. Називають її водневим зв'язком.
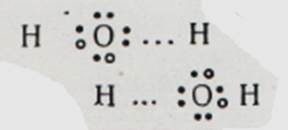
Так само відбувається асоціація молекул фтористого водню:
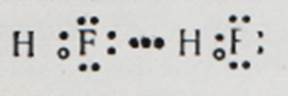
В цьому випадку водневий зв'язок виявляється особливо міцним, так що в розчинах фтористоводневої кислоти, крім звичних нам іонів:
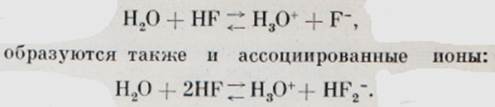
Водневий зв'язок схожий на вже знайомий нам координаційний зв'язок, утворений за рахунок «чужої» пари електронів. Такий зв'язок утворюється не обов'язково між однаковими молекулами. Ось що відбувається, наприклад, при розчиненні аміаку у воді:
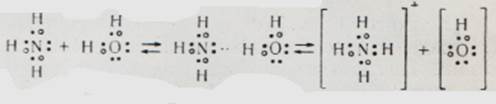
У властивостях гідридів чітко проявляється періодичність. Візьмемо, наприклад, гідриди неметалів другого періоду. Метан - речовина зовсім нейтральногохарактеру, своєрідний "інертний" газ. Далі слідує аміак, здатний приєднувати іони водню і тому володіє основнимивластивостями. Фтористий водень, як відомо, кислота, авода, що стоїть у нашій таблиці між аміаком і фтористим воднем, у певному сенсі є амфотерним електролітом.Справді, у реакції з аміаком вода поводиться як кислота (віддаєпротон):
При взаємодії з фтористим воднем вона пов'язуєпротон, тобто поводиться як основа:
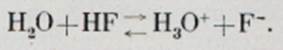
Чим нижче гідрид у нашій таблиці, тим слабкішими стають його основні властивості, якщо вимірювати їх здатністю реагувати з кислотами. Дійсно, широко відомі солі амонію, що утворюються з аміаку та кислот. А гідрид фосфору РН 3 , який у принципі теж здатний приєднувати протон, даючи іон фосфонію РН 4 + утворює лише кілька стійких солей з найсильнішими кислотами, наприклад (PH 4) + ClO 4 - .
Кислотні властивості гідридів, навпаки, збільшуються зверху вниз. Так, кислотні властивості у сірководню вище, ніж у води, та якщо з галогеноводородних кислот найслабша фтористоводнева. На прикладі гідридів неметалів можна простежити дію найважливішого закону природи: між протилежними властивостями немає непрохідної межі, у кожному явищі борються протилежні тенденції, причому залежно від умов або перемагає одна з них, або відбувається їх синтез, поєднання, перехід однієї протилежності в іншу. Цей закон допоможе нам зрозуміти деякі цікаві явища, можливо дещо несподівані і незвичайні.
Хімія
НЕОРГАНІЧНА ХІМІЯ. ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
1. Водень
Властивості 1 H.
Атомна маса |
кларк, ат.% (поширеність у природі) |
||
Електронна конфігурація* |
Агрегатний стан |
||
безбарвний |
|||
Енергія іонізації
|
|||
Відносна електронегативність |
Щільність |
||
Можливі ступені окислення |
Стандартний електродний потенціал |
*Наведено конфігурацію зовнішніх електронних рівнів атома елемента. Конфігурація інших електронних рівнів збігається з такою для благородного газу, що завершує попередній період і вказаний у дужках.
Атом водню складається з одного протону та одного електрона. Цей найпростіший атом не має аналогів у періодичній системі.Він здатний втрачати електрон, перетворюючись на катіонН
+ , і в цьому відношенні подібний до лужних металів, які також виявляють ступінь окислення 1+. Атом водню може приєднувати електрон, утворюючи при цьому аніонН-, електронна конфігурація якого така сама, як у атома гелію. Щодо цього водень подібний до галогенів, аніони яких мають електронні зміни сусідніх шляхетних газів.Таким чином, водень має подвійну природу, виявляючи як окисну, так і відновлювальну здатність. Тому в одних випадках водень поміщають у підгрупу лужних металів, в інших - в підгрупу галогенів.
Хімічні характеристики. Енергія зв'язку в молекулі водню
H 2 становить 436 кДж/моль. Велика величина енергії зв'язку пояснює порівняно малу активність молекулярноговодню за звичайних умов. Так, за кімнатної температури водень реагує лише з фтором:![]()
та з хлором при ультрафіолетовому опроміненні.
При підвищеній температурі водень реагує з багатьма речовинами: він згоряє в атмосфері кисню з утворенням води та виділенням великої кількостітеплоти:
![]()
З'єднання водню з неметалами.
При нагріванні водень оборотно реагує також з бромом, йодом, сіркою та азотом, причому з останнім лише у присутності каталізатора та при високому тиску.Водень при нагріванні здатний реагувати не тільки з простими, але і складними речовинами:
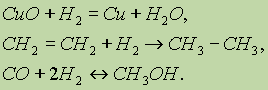
У всіх аналізованих реакціях водень є відновником,утворюючи сполуки, де його ступінь окиснення дорівнює 1+.
З'єднання водню з металами. З багатьма металами водень вступає в реакції при підвищених температурі та тиску з утворенням гідридів
(NaH, KH, СаН 2 , де його ступінь окислення дорівнює 1-:![]()
Гідрид натрію - біла кристалічна сполука, що за фізичними властивостями нагадує хлорид натрію. Однак хімічні властивості NaH та
NaCI сильно різняться. Так, хлорид натрію розчиняється у воді та дисоціює у розчині на іони. Гідрид натрію водою розкладається з утворенням лугу та водню:Отримання.
Для промислового отримання водню використовують такі способи:1. Електроліз водяних розчинів хлоридів.
2. Пропускання парів води над розпеченим вугіллям за температури 1000 ° З:
3. Конверсія метану при високих температурах:
4. Крекінг вуглеводнів.
Для лабораторного одержання водню використовують такі способи:
1. Взаємодія металів із кислотами:
2. Взаємодія лужноземельних металів
з водою:3. Взаємодія алюмінію або кремнію з водними розчинами лугів:
4. Взаємодія гідридів із водою.
Вода. Оксид водню - одна з найпоширеніших і найважливіших речовин. Поверхня Землі, зайнята водою, в 2,5 рази більша за поверхню суші. Чистої води в природі немає, вона завжди містить домішки. Отримують чисту воду шляхом перегонки. Перегнана вода називається дистильованою.Склад води (за масою): 11,19% водню та 88,81% кисню.
Фізичні характеристики. Чиста водапрозора, не має запаху та смаку. Найбільшу щільність має при 0 °С (1 г/см 3 ). Щільність льоду менша за щільність рідкої водитому лід спливає на поверхню. Вода замерзає при 0°З кипить при 100° при тиску 101 325 Па. Вона погано проводить теплоту та дуже погано проводить електрику. Вода – добрий розчинник.Молекула води має кутову форму: атоми водню по відношенню до кисню утворюють кут, що дорівнює 104,5°. Тому молекула води – диполь: та частина молекули, де знаходиться водень, заряджена позитивно, а частина, де знаходиться кисень, – негативно. Завдяки полярності молекул води електроліти у ній дисоціюють на іони.
У рідкій воді поряд із звичайними молекулами Н
2 Про містяться асоційовані молекули, тобто з'єднані в складніші агрегати (Н 2 О) х, завдяки утворенню водневих зв'язків. Наявністю водневих зв'язків між молекулами води пояснюються її аномалії фізичних властивостей; максимальна щільність при 4°, висока температуракипіння (у ряді Н 2 Про - H 2 S - H 2 Se - Н 2 Ті), аномально висока теплоємність . З підвищенням температури водневі зв'язки розриваються, і повний розрив настає при переході води в пару.Хімічні характеристики. Вода - дуже реакційна речовина. За звичайних умов вона взаємодіє з багатьма основними та кислотними оксидами, а також із лужними та лужноземельними металами:
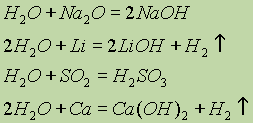
Вода утворює численні сполуки - гідрати (кристаллогідрати
):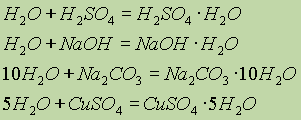
Очевидно, сполуки, що зв'язують воду, можуть служити як осушувачів.З інших осушуючих речовин можна вказати Р
2 O 5 , СаО, ВаО, металевий Na (Вони теж хімічно взаємодіють з водою), а також силікагель.До важливих хімічним властивостямводи відноситься її здатність вступати в реакції гідролітичного розкладання.
Тяжка вода
. Вода, що містить важкий водень, називається важкою водою(позначається формулою D2O). Як це видно зі зіставлення фізичних властивостей, вона відрізняється від звичайної води: (у дужках наведено характеристики звичайної води (H 2 O))Молекулярна маса: 20 (18)
Щільність при 20
°З, г/см 3: 1,1050 (0,9982)Температура кристалізації
, C: 3,8 (0)Температура кипіння, °С:
101,4 (100)Хімічні реакції з важкою водою протікають значно повільніше, ніж із звичайною водою. Тому при тривалому електролізі звичайної води накопичується в электролизере.
Тяжка вода застосовується як сповільнювач нейтронів у ядерних реакторах.
Copyright © 2005-2013 Xenoid v2.0
Використання матеріалів сайту можливе за умови вказівки активного посилання
