| Найменування параметру | Значення |
| Тема статті: | Сірководень |
| Рубрика (тематична категорія) | Метали та Зварювання |
Одержання сірки
Хімічні властивостісірки
При кімнатній температурі сірка входить у реакції лише з ртуттю. Зі підвищенням температури її активність значно підвищується. При нагріванні сірка безпосередньо реагує з багатьма простими речовинами, За винятком інертних газів, азоту селена, телуру, золота платини, іридію і йоду. Сульфіди азоту та золота отримані непрямим шляхом.
- Взаємодія з металами
Сірка виявляє окисні властивості, в результаті взаємодії утворюються сульфіди:
- Взаємодія з воднем відбувається за 150–200 °С:
H2+S=H2S.
- Взаємодія з киснем
Сірка горить у кисні при 280 °С, на повітрі при 360 °С, при цьому утворюється суміш оксидів:
S + O 2 = SO 2;
2S + 3O2 = 2SO3.
- Взаємодія з фосфором та вуглецем
При нагріванні без доступу повітря сірка реагує з фосфором, вуглецем, виявляючи окисні властивості:
2P + 3S = P 2 S 3;
- Взаємодія із фтором
У присутності сильних окисників виявляє відновлювальні властивості:
S + 3F2 = SF6.
- Взаємодія зі складними речовинами
При взаємодії зі складними речовинами сірка поводиться як відновник:
S + 2HNO 3 = 2NO + H 2 SO 4 .
- Реакція диспропорціонування
Сірка здатна до реакцій диспропорціонування, при взаємодії з лугом утворюються сульфіди та сульфіти:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
- З самородних руд
- При нагріванні піриту без доступу повітря
FeS 2 = FeS + S.
- Окисленням сірководню при нестачі кисню
2H 2 S + O 2 = 2S + 2H 2 O.
- З газів, що відходять, металургійних і коксових печей, при нагріванні в присутності каталізатора.
H 2 S + SO 2 = 2H 2 O + 3S.
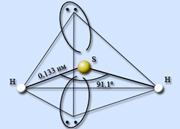
Водневе з'єднання сірки - сірководень H 2 S . Сірководень - ковалентне з'єднання. Будова молекули аналогічна до будови молекули води, атом сірки перебуває у стані sp 3 -гібридизації, проте на відміну від води молекули сірководню не утворюють між собою водневих зв'язків. Атом сірки менш електронегативний, ніж атом кисню, має більший розмірі, як наслідок, меншу щільність заряду. Валентний кут HSH становить 91,1 °, довжина зв'язку H - S дорівнює 0,133 нм.
Сірководень - поняття та види. Класифікація та особливості категорії "Сіроводень" 2014, 2015.
Балансові запаси цих компонентів підлягають обліку в межах газових, газоконденсатних, газонафтових родовищ, якщо: - розвідані запаси газу на родовищі складають не менше 10 млрд. м3; - запаси цих компонентів у відсотковому співвідношенні становлять не... .
Отруєння невідомими рідинами Вживання помилково або навмисно, сподіваючись, що це етиловий (харчовий) спирт або вода, невідомих рідин призводить до отруєння організму. Ознаки таких отруєнь: біль у шлунку, розлад шлунка,... .
Рис. 2.4. Випарник Мал. 2.3. Десорбер Мал. 2.2. Абсорбер Мал. 2.5. Теплообмінник «труба в трубі» Метод низькотемпературної сепарації широко застосовується для: осушування газу; виділення конденсату із газу газоконденсатних родовищ на... .
ГАЗА ДО ДАЛЬНЬОГО ТРАНСПОРТУ. ОБЛАДНАННЯ ДЛЯ ОЧИЩЕННЯ І ПІДГОТОВКИ РОЗДІЛ 1 Рис. 2. Ізоляція магістрального трубопроводу Природний газ, що надходить із свердловин, містить у вигляді домішок тверді частинки (пісок, окалина), конденсат... .
Хімічні властивості Фізичні властивостіПри звичайних умовахсірководень – безбарвний газ, із сильним характерним запахом тухлих яєць. Тпл = -86 ° С, Ткіп = -60 ° С, погано розчинний у воді, при 20 ° С в 100 г води розчиняється 2,58 мл H2S. Дуже отруйна, при вдиханні викликає... .
Молекула сірководню Сірководень – безбарвний газ із запахом тухлих яєць. Він добре розчиняється у воді (при 20°С у 1 об'ємі води розчиняється 2,5 об'єму сірководню). Сірководень можна одержати безпосереднім з'єднанням сірки з воднем при нагріванні, але зазвичай...
ВИЗНАЧЕННЯ
Сірководеньє безбарвним газом з характерним запахом гниючого білка.
Він трохи важчий за повітря, зріджується при температурі -60,3 o С і твердне при -85,6 o С. На повітрі сірководень горить блакитним полум'ям, утворюючи діоксид сірки і воду:
2H 2 S + 3O 2 = 2H 2 O + 2SO 2 .
Якщо внести в полум'я сірководню якийсь холодний предмет, наприклад фарфорову чашку, то температура полум'я значно знижується і сірководень окислюється тільки до вільної сірки, що осідає на чашці у вигляді жовтого нальоту:
2H 2 S + O 2 = 2H 2 O + 2S.
Сірководень легко спалахує; суміш його з повітрям підриває. Сірководень дуже отруйний. Тривале зітхання повітря, що містить газ навіть у невеликих кількостях, викликає важкі отруєння.
При 20 o З один об'єм води розчиняє 2,5 об'єму сірководню. Розчин сірководню у воді називається сірководневою водою. При стоянні на повітрі, особливо на світлі, сірководнева вода скоро стає каламутною від сірки, що виділяється. Це відбувається внаслідок окислення сірководню киснем повітря.
Одержання сірководню
При високій температурісірка взаємодіє з воднем, утворюючи газ сірководень.
Практично сірководень зазвичай отримують дією розведених кислот на сірчисті метали, наприклад, на сульфід заліза:
FeS + 2HCl = FeCl 2 + H 2 S.
Чистіший сірководень можна отримати при гідролізі CaS, BaS або A12S3. Найчистіший газ виходить прямою реакцією водню і сірки при 600 °С.
Хімічні властивості сірководню
Розчин сірководню у воді має властивості кислота. Сірководень – слабка двоосновна кислота. Вона дисоціює східчасто і в основному по першому ступені:
H 2 S↔H + + HS - (K 1 = 6×10 -8).
Дисоціація по другому ступені
HS - ↔H + + S 2- (K 2 = 10 -14)
протікає в мізерно малому ступені.
Сірководень – сильний відновник. При дії сильних окислювачів він окислюється до діоксиду сірки або сірчаної кислоти; глибина окиснення залежить від умов: температури, рН розчину, концентрації окисника. Наприклад, реакція з хлором зазвичай протікає до утворення сірчаної кислоти:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Середні солі сірководню називають сульфідами.
Застосування сірководню
Застосування сірководню досить обмежене, що насамперед пов'язане з його високою токсичністю. Він знайшов застосування в лабораторній практиці як осадник важких металів. Сірководень служить сировиною для отримання сірчаної кислоти, сірки в елементарному вигляді та сульфідів
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Визначте у скільки разів важчий за повітря сірководень H 2 S. |
| Рішення | Відношення маси даного газу до маси іншого газу, взятого в тому ж обсязі, при тій же температурі і тому ж тиску, називається відносною щільністю першого газу по другому. Ця величина показує, у скільки разів перший газ важчий або легший за другий газ. Відносну молекулярну масу повітря приймають рівною 29 (з урахуванням вмісту повітря азоту, кисню та інших газів). Слід зазначити, що поняття «відносна молекулярна маса повітря» використовується умовно, оскільки повітря це суміш газів. D air (H 2 S) = M r (H 2 S) / M r (air); D air (H 2 S) = 34/29 = 1,17. M r (H 2 S) = 2 × A r (H) + A r (S) = 2 × 1 + 32 = 2 + 32 = 34. |
| Відповідь | Сірководень H 2 S важчий за повітря в 1,17 разів. |
ПРИКЛАД 2
| Завдання | Знайдіть щільність водню суміші газів, у якій об'ємна частка кисню становить 20%, водню - 40%, решта - сірководень H 2 S. |
| Рішення | Об'ємні частки газів співпадатимуть з молярними, тобто. з частками кількості речовин, це наслідок із закону Авогадро. Знайдемо умовну молекулярну масу суміші: M r conditional (mixture) = φ (O 2) × M r (O 2) + φ (H 2) × M r (H 2) + φ (H 2 S) × M r (H 2 S); |
Хімічні властивості
Фізичні властивості
За звичайних умов сірководень – безбарвний газ, із сильним характерним запахом тухлих яєць. Тпл = -86 °С, Ткип = -60 °С, погано розчинний у воді, при 20 °С в 100 г води розчиняється 2,58 мл H 2 S. Дуже отруйний, при вдиханні викликає параліч, що може призвести до смертельного результату. У природі виділяється у складі вулканічних газів, утворюється при гниття рослинних та тваринних організмів. Добре розчинний у воді, при розчиненні утворює слабку сірководневу кислоту.
- У водному розчині сірководень має властивості слабкої двоосновної кислоти:
H 2 S = HS - + H +;
HS - = S 2 - + H +.
- Сірководень горить у повітрі Синє полум'я. При обмеженому доступі повітря утворюється вільна сірка:
2H 2 S + O 2 = 2H 2 O + 2S.
При надмірному доступі повітря горіння сірководню призводить до утворення оксиду сірки (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SО 2 .
- Сірководень має відновлювальні властивості. В залежності від умов сірководень може окислюватися у водному розчині до сірки, сірчистого газу та сірчаної кислоти.
Наприклад, він знебарвлює бромну воду:
H2S+Br2=2HBr+S.
взаємодіє з хлорною водою:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Струмінь сірководню можна підпалити, використовуючи діоксид свинцю, так як реакція супроводжується великим виділенням тепла:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
- Взаємодія сірководню із сірчистим газом використовується для отримання сірки з відхідних газів металургійного та сірчанокислого виробництва:
SO 2 + 2H 2 S = 3S + 2H2O.
Із цим процесом пов'язано утворення самородної сірки при вулканічних процесах.
- При одночасному пропусканні сірчистого газу та сірководню через розчин лугу утворюється тіосульфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
- Реакція розведеної соляної кислоти із сульфідом заліза (II)
FeS + 2HCl = FeCl 2 + H 2 S
- Взаємодія сульфіду алюмінію з холодною водою
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S
- Прямий синтез із елементів відбувається при пропущенні водню над розплавленою сіркою:
H2+S=H2S.
- Нагрівання суміші парафіну із сіркою.
1.9. Сірководнева кислота та її солі
Сірководневої кислотипритаманні всі властивості слабких кислот. Вона реагує з металами, оксидами металів, основами.
Як двоосновна кислота утворює два типи солей – сульфіди та гідросульфіди . Гідросульфіди добре розчиняються у воді, сульфіди лужних і лужноземельних металів також, сульфіди важких металів практично нерозчинні.
Сульфіди лужних і лужноземельних металів не пофарбовані, решта мають характерне забарвлення, наприклад, сульфіди міді (II), нікелю та свинцю – чорні, кадмію, індію, олова – жовті, сурми – помаранчевий.
Іонні сульфіди лужних металів M 2 S мають структуру типу флюориту, де кожен атом сірки оточений кубом із 8 атомів металу і кожен атом металу – тетраедром із 4 атомів сірки. Сульфіди типу MS характерні для лужноземельних металів та мають структуру типу хлориду натрію, де кожен атом металу та сірки оточений октаедром з атомів іншого сорту. За посилення ковалентного характеру зв'язку метал – сірка реалізуються структури з меншими координаційними числами.
Сульфіди кольорових металів зустрічаються в природі як мінерали та руди, служать сировиною для отримання металів.
