













 Назад Вперед
Назад Вперед
Увага! Попередній перегляд слайдів використовується виключно для ознайомлення та може не давати уявлення про всі можливості презентації. Якщо вас зацікавила дана робота, будь ласка, завантажте повну версію.
Цілі уроку:
Навчальні цілі:Актуалізувати знання про метали: становище у Періодичній системі, особливості будови атомів, фізичні властивості. Вивчити становище неметалів у Періодичній системі та особливості будови їх атомів. Повторити кристалічну будову неметалів, отже, розглянути їх фізичні властивості.
Цілі, що виховують:Створювати умови на формування в учнів здібності слухати одне одного, аналізувати і доповнювати відповіді товаришів.
Розвиваючі цілі:Сприяти розвитку у учнів логічного мислення, сприяти вмінню учнів описувати властивості речовин
Обладнання:Зразки неметалів, наявні у лабораторії.
Тип уроку:Водний урок, вивчення нових знань.
Методи, що застосовуються на уроці:
- Евристична розмова.
- Антитеза – протиставлення одних об'єктів природи іншим: неметалів металів.
- Спостереження (описати властивості речовин за фотографіями).
Хід уроку
I. Організаційний момент.
ІІ. Введення у тему уроку.
Вчитель починає урок з демонстрації першого слайду (слайд 1)та питання учням:
Що зображено на фотографіях?
Розгляньте фотографії та згадайте, яку тему ви вивчали до сьогоднішнього уроку?
Відповідь учнів:
- метали.
Сьогодні почнемо вивчати речовини, що використовуються для виготовлення предметів, зображених на другому слайді (слайд 2).
Які це речовини?
Відповідь учнів:
- Неметали.
Отже – тема уроку «Загальна характеристика неметалів» (Слайд 3).
3. Загальна характеристика неметалів
Властивості та хімія елементів-неметалів є складнішими та різноманітнішими порівняно з такими для металів.
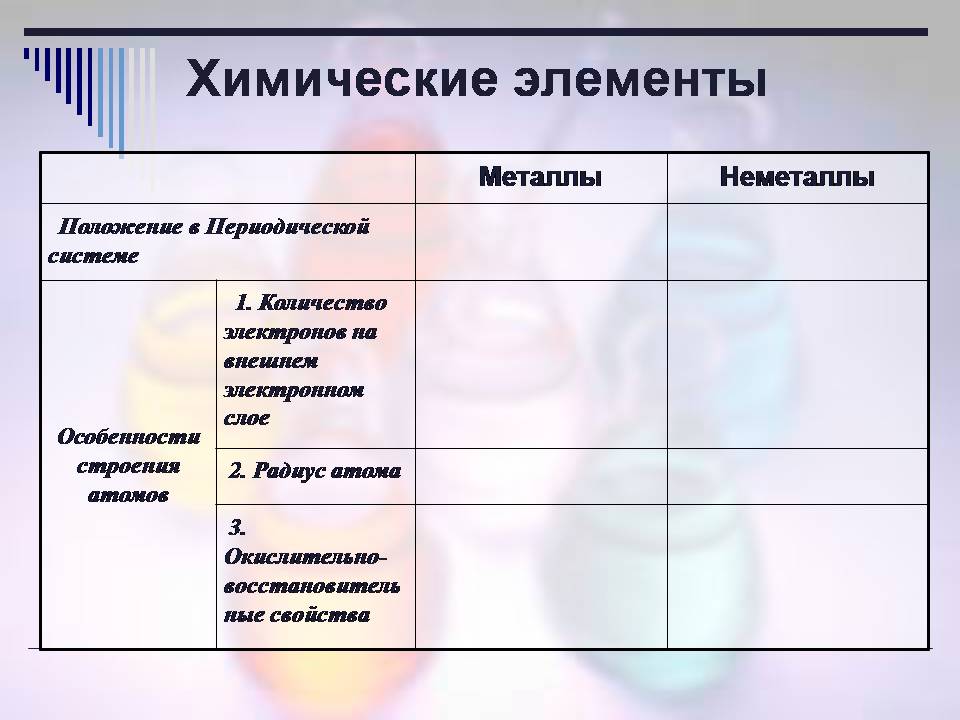
Сьогодні ми порівнюватимемо властивості металів і неметалів, і протягом уроку записуватимемо свої висновки в таблицю 1 (слайд 4).
Таблиця 1. Порівняння властивостей металів та неметалів.
| Характеристика | Метали | Неметали | |
| 1. Хімічні елементи | |||
| Положення у Періодичній системі | |||
| Особливості будови атомів | 1. Кількість електронів на зовнішньому електронному шарі | ||
| 2. Радіус атома | |||
| 3. Окисно-відновні властивості | |||
| 2. Прості речовини | |||
| Тип хімічного зв'язку | |||
| Кристалічні грати | |||
| Загальні фізичні властивості | 1. Стан за звичайних умов | ||
| 2. Колір | |||
| 3. Блиск | |||
| 4. Пластичність або крихкість | |||
| 5. Тепло- та електропровідність | |||
Таблиця представлена на слайдах і ми зможемо перевіряти правильність протягом уроку.
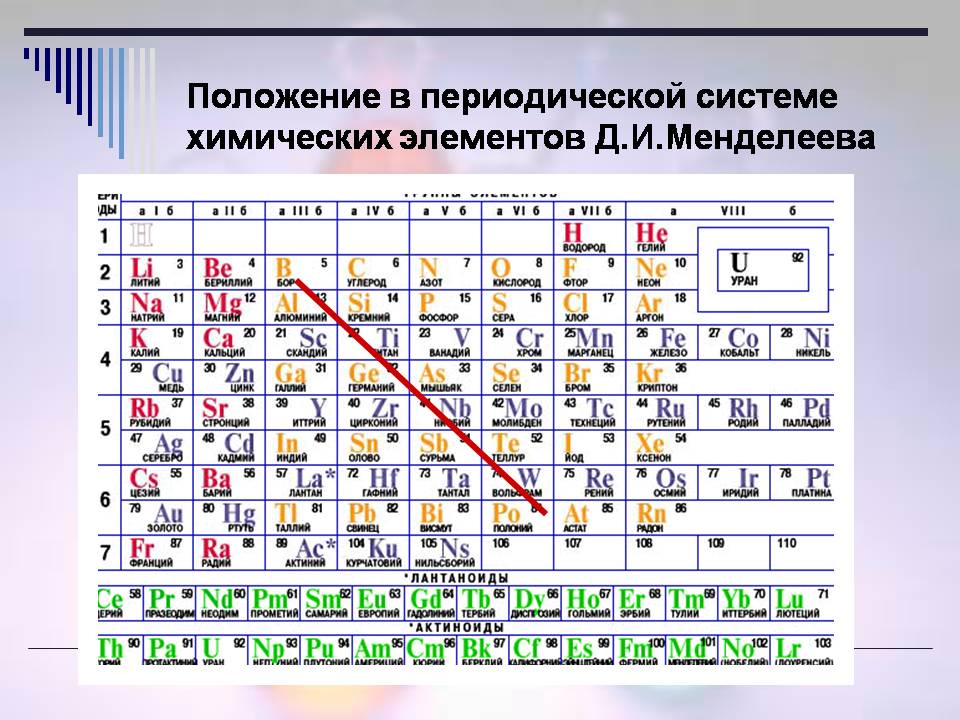
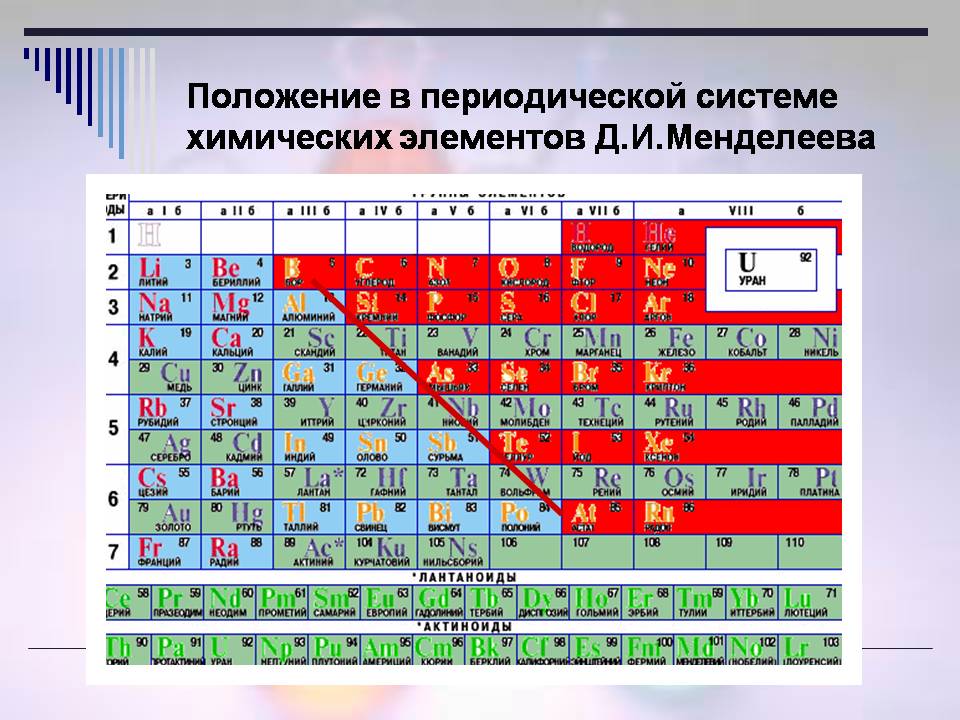
а. Положення неметалів у ПС.
Розглянувши ПС, згадайте, де є метали (слайди 5, 6 та 7)?
Відповідь учнів:
- У основних підгрупах нижче діагоналі В – At
- У побічних підгрупах
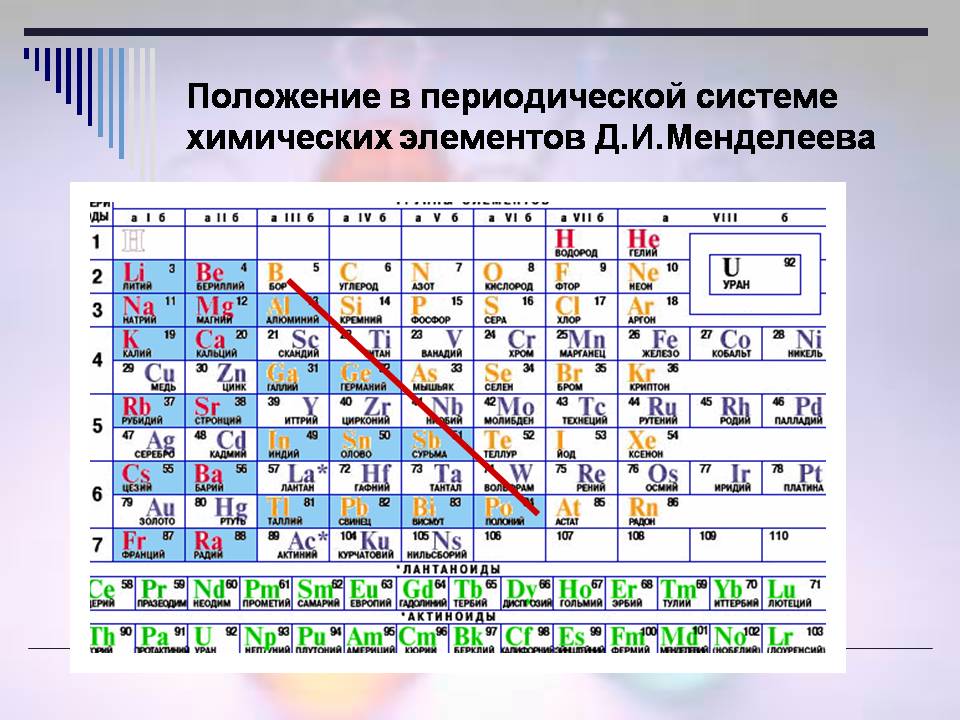
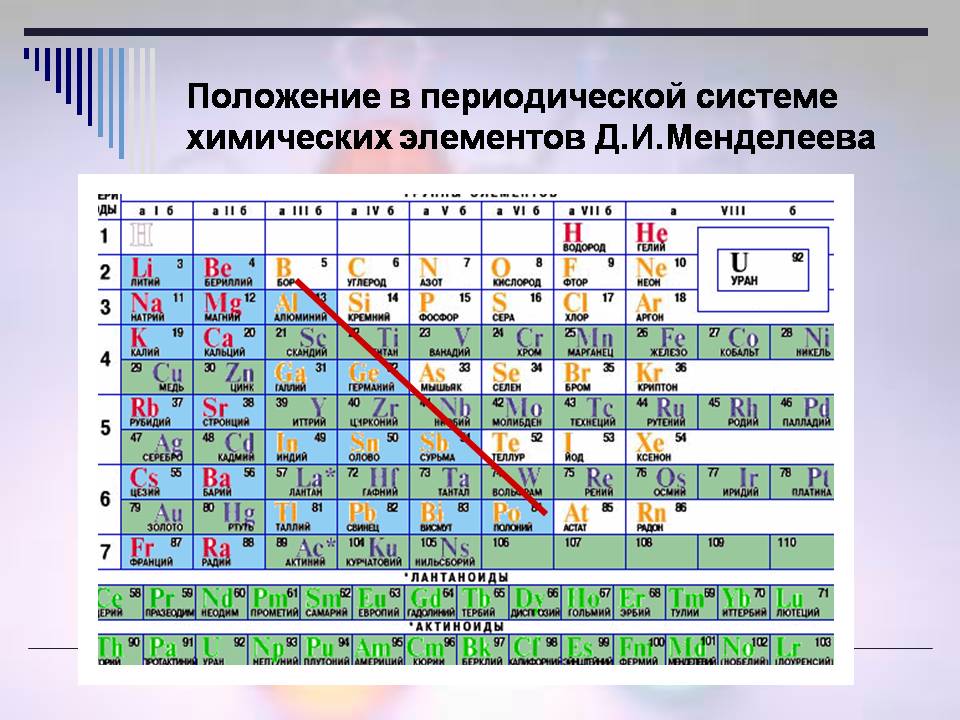
Тоді, де знаходяться неметали (Слайд 8)?
Відповідь учнів:
- Неметали розташовані у правому верхньому кутку ПСХЗ (вздовж і над діагоналлю В – At).
Усього 22 елементи є неметалами в періодичній системі.
Запишемо до таблиці.
б. Особливості атомної будови елементів-неметалів.
Тепер розглянемо особливості будови атомів.
Запишемо схеми будови атомів, елементів, записаних на дошці (слайд 9).
У правій колонці – метали, у лівій – неметали.
Розглянемо зовнішній шар:
Відповідь учнів:
- У металів.
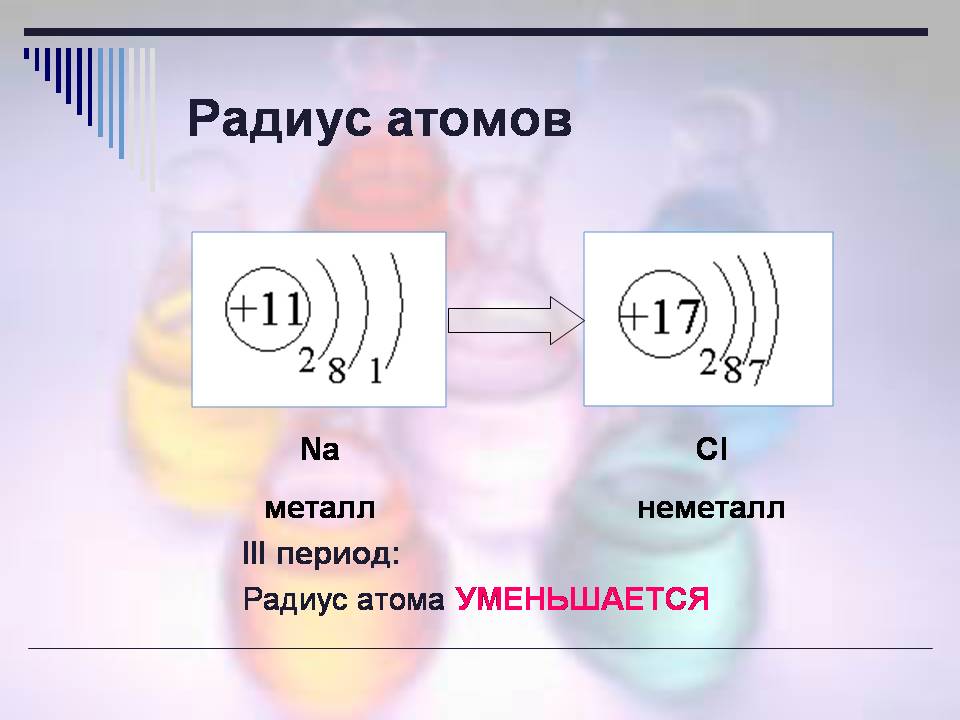
Наступна характеристика: Радіус атома.
Розгляньте картинки (слайд 10)і дайте відповідь на питання: які це елементи, що спільного в їх розташуванні в ПС?
Відповідь учнів:
- Це елементи натрій та хлор, розташовані у 3 періоді.
Як змінюється радіус атомів у періоді?
Відповідь учнів:
- Зменшується.
Т. е. у неметалів радіус менше.
Запишемо до таблиці.
Переходимо до окислювально-відновних властивостей.
Згадаємо – метали виявляють ….. відновлювальні…. властивості.
А неметали?
Відповідь учнів:
- Окисні.
Розберемося?
Розглянемо реакції горіння деяких неметалів у кисні.
Докладніше розберемо горіння сірки. Запишемо рівняння, баланс (слайд 11).
Тобто. неметали та окислювачі та відновники.
Ми розглянули хімічні елементи, перевіримо таблицю (слайд 12).
в. Характеристика простих речовиннеметалів.
Тепер переходимо до простих речовин.
Працюємо з другою частиною таблиці (слайд 13).
Перше – тип зв'язку.
Яким зв'язком утворені прості речовини метали?
Відповідь учнів:
- Металевої
Неметали?
Відповідь учнів:
- Ковалентної неполярної.
Записали.
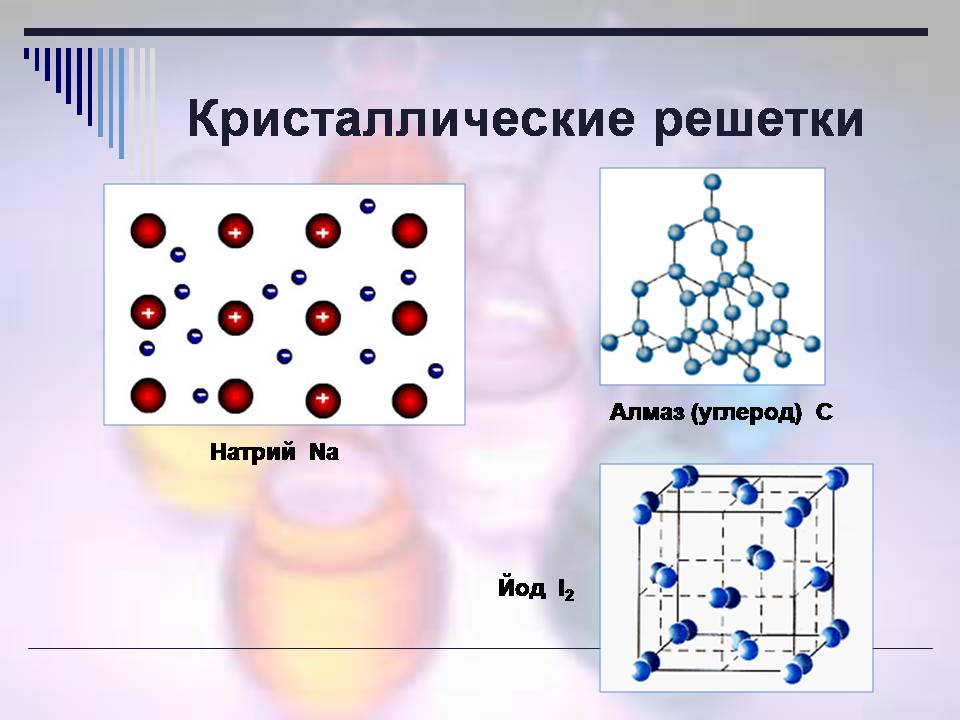
Який тип кристалічних ґрат у речовин із металевим зв'язком (слайд 14)?
Відповідь учнів:
- Металева
Ковалентної неполярної? Перш ніж відповісти, зверніть увагу на малюнки. слайд.
Відповідь учнів:
- Атомна чи молекулярна.
Записали.
Кристалічні грати визначає фізичні властивості речовин.
Згадаймо фізичні властивості речовин із металевими ґратами.
За таблицею.
А які у неметалів. Розглянемо (Слайди 15-17).
Тепер перевіримо наші записи (Слайд 18).
ІІІ. Повторення.
на зворотній сторонілиста поставте в стовпчик п'ять цифр, і дайте відповідь «Так» або «Ні» на запитання, представлені на слайді. (слайд 20).
Перевіримо (слайд 21).
У кого все правильно – підніміть руку.
Наприкінці уроку вчитель може виставити позначки найактивнішим учням.
Висновок:
Неметали – хімічні елементи, атоми яких мають велику кількість електронів на зовнішньому електронному шарі, малий радіус і мають переважно окислювальні властивості.
Неметали - прості речовини не мають фізичних властивостей металів, виявляють велику різноманітність у властивостях, що пояснюється різними типами кристалічних грат.
Слайд 5із презентації «Метали та неметали». Розмір архіву із презентацією 137 КБ.
Хімія 8 клас
короткий змістінших презентацій"Кислоти 8 клас" - Згадайте, що ми знаємо про кислоти на прикладі. Подумайте! www.undersky.ru. H2CO3. images.yandex.ru. www.sunhome.ru. Металу (неметалу) Солеутворюючий (несолеутворюючий) Кислотний (основний). Прохорова Світлана Миколаївна. Дайте характеристику оксидам.
"Солі 8 клас" - Назвіть речовини: Складна речовина, що складається з іону металу та кислотного залишку. Дати назву: MgSO4 Al2(SO4)3 Fe(NO3)3 CaCO3 NaCl. Хімія – 8 клас. Склади формулу: З переліку виписати: Оксиди; Підстави; Кислоти. Оксидами Основами кислотами. Урок хімії у 8 класі на тему: Caco3 – мармур, вапняк, крейда. Що називається: Сіль -. Мета уроку: CaO Ca(OH)2 HNO3 Al2(SO4)3 H3PO4 CO2 H2S NaCl Mg(OH)2 CaCO3.
"Будова речовина хімія" - Гази, рідини, тверді тіла. Як змінювалися уявлення про атоми з часом? Автор однієї з моделей отримав Нобелівську премію двічі. Кластер найважливішої молекули Землі. Як вчені дізнаються про будову речовини? Атомний рівень організації речовини. Чи завжди атоми менші за молекули? Речовина та тіло. Молекули. Що таке атом? МОУ Ліцей № 40 БУДОВА РЕЧОВИНИ. Назвіть імена вчених, які вивчали (вивчають) будову речовини. Браун, Лемей. Що таке молекула?
«Урок Кисень» - Купцова А.А.Методична розробка уроку з хімії «Кисень. Передмова. Цілі: Тому робота з учнями вимагає від вчителя постійного методичного технічного вдосконалення. Готую презентації до уроків, щоб урізноманітнити форми уроків хімії учнів. У пропонованій методичної розробкипредставлено розробку уроку «Кисень. ІКТ надає велику допомогутакож під час підготовки та проведення уроків. Випуск 2./Під загальною редакцією Н.В.Борисової. - Чебоксари, 2010. - 208 с.).
«Речовина у хімії» - Кисень. Речовини. Вода Залізо Кисень Мідь Алюміній Хлорофіл Сахар. Здатність реагувати коїться з іншими речовинами. Дерево. Водень. Хімічні. Проста речовина. Сьогодні ми починаємо вивчати одну з найдавніших з важливих наук-хімію. Метан. Вчитель: Харгелюнова І.Г. МОУ Виноградненська ЗОШ. Прості. Ацетон. Тверді речовини. Метал. Вільні атоми.
«Складні та прості речовини» - Більшість металів мають сірий, сріблясто-білий колір. Прості речовини. Сірка, хлор, алмаз та багато інших є представниками неметалів. Складні речовини. Над презентацією працювала Патокіна Юлія учениця 8-б кл. Відомо понад 80 різних металів. Утворення складної речовини із простих називається синтезом. Визначення складу складної речовини шляхом розкладання називається аналізом. Метали.
