НЕМЕТАЛИ природні сполуки застосування продуктів їхньої переробки
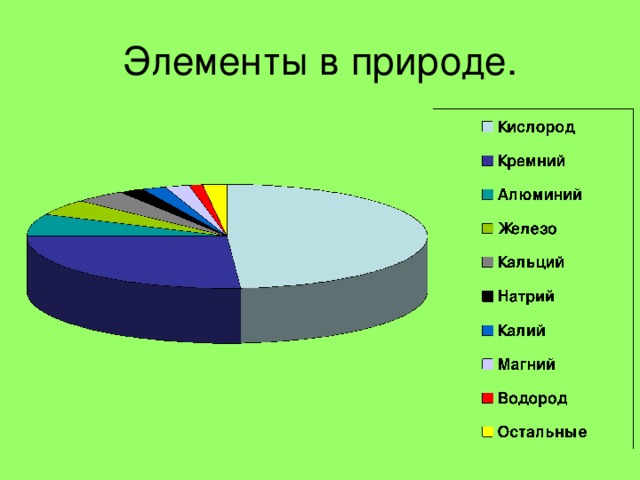

Знаходження у природі .
Самородні елементи
Азот та кисень, інертні гази у складі повітря
Сірка
Графіт С
Алмаз С

Знаходження у природі
← Апатити Р
Галіт NaCl →
← FeS 2 пірит
Кварц SiO 2 →

Неметали - це хімічні елементи, які можуть виявляти властивості як окислювача (Приймають електрони), так і відновлювача (Віддають електрони).
Нім - Елементи з високою ОЕО (2 - 4)
Винятки: фтор - Тільки окислювач,
інертні гази – можуть лише віддавати електрони.
Гелій, неон та аргон – сполук не утворюють.
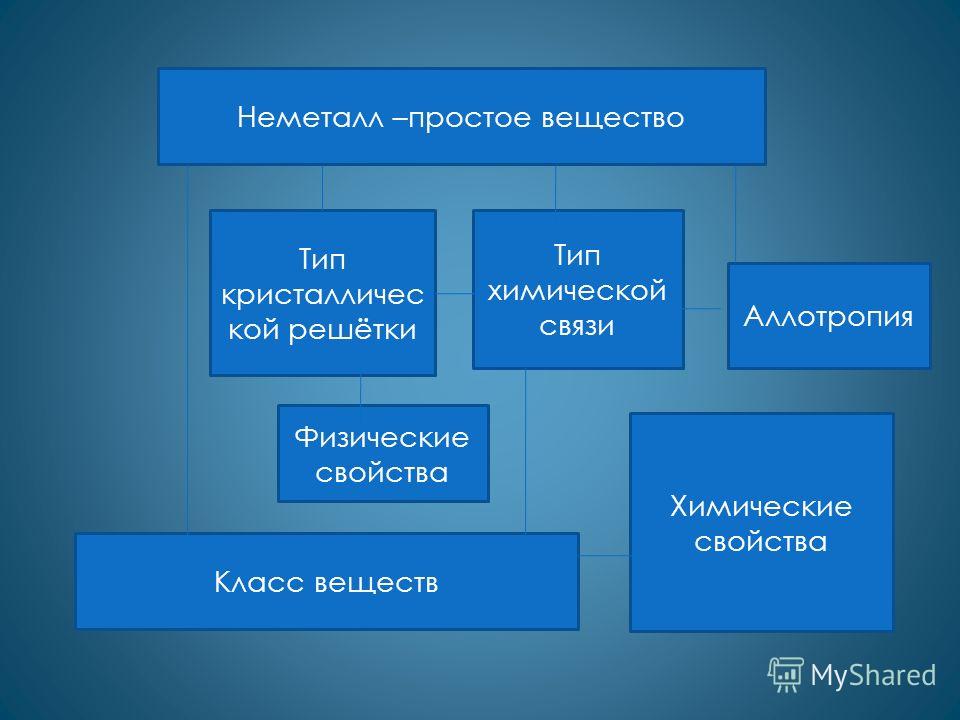
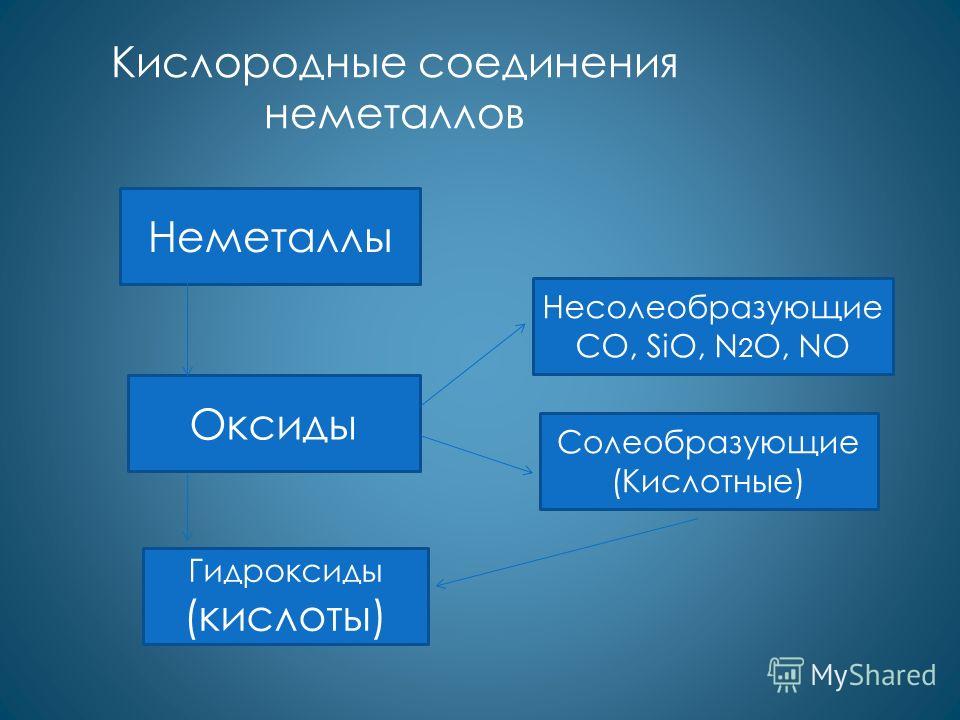
З'єднання неметалів.
- Оксиди – тільки кислотні
SO 3 , SO 2 , CO 2 та інші.
- (крім NO і CO -байдужі)
- Гідроксиди – тільки кислоти
H 2 SO 4 , H 2 SO 3 ,H 2 CO 3 та інші
Утворюють леткі сполуки з воднем HCl, NH 3 …
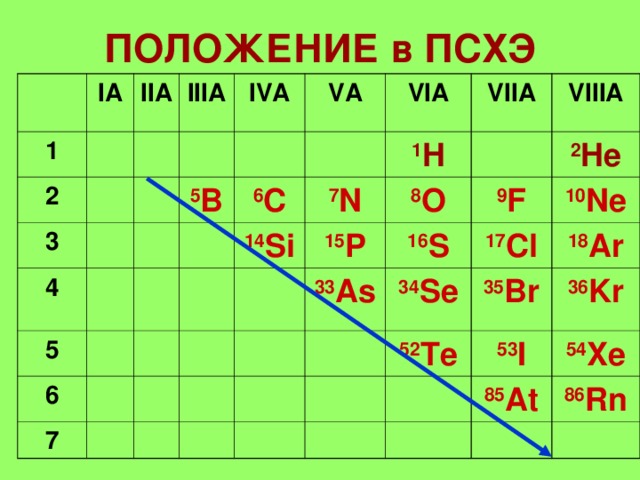
ПОЛОЖЕННЯ ПСХЕ
I А
II А
III А
IV А
V А
5 B
VI А
6 C
VII А
14 Si
1 H
7 N
VIII А
15 P
8 O
16 S
2 He
9 F
33 As
34 Se
10 Ne
17 Cl
35 Br
52 Te
18 Ar
36 Kr
53 I
54 Xe
85 At
86 Rn

ЕЛЕМЕНТИ - IA,IIIA,IVA

ПНІКТОГЕНИ -VA

ХАЛЬКОГЕНИ - VIA

ГАЛОГЕНИ - VIIA

ІНЕРТНІ ГАЗИ- VIIIA

Будова атомів НМ
1. Елементи розташовані у головних підгрупах III –VIII груп (А).
2. На останньому рівні 3 - 7 (8) електронів.
3. Радіус атома зменшується
4. Неметалічні властивості
У періоді – збільшуються
У групі – зменшуються

Будова атомів НМ
- 5. Висока електронегативність.
- 6. Приймають електрони та віддають.
- 7. НМ → кислотний оксид → кислота
- 8. Летючі водневі сполуки
(кислоти, основи та байдужі)

- Агрегатний стан .
- Газоподібні - азот, кисень, хлор, інертні гази, водень.
- Рідкий – бром,
- Тверді – сірка, фосфор, вуглець…
- Розчинність у воді.
- Нерозчинні.
- Відношення до електричного струму.
- Неелектропровідні: сірка, кисень.
- Провідники: графіт
- Напівпровідники: кремній

Будова неметалів .
- Молекулярне (НМ), де
- Інертні гази He, Ar, Ne…
- H 2 , Cl 2 , N 2 …
- P 4 білий
- P n червоний
- Атомна будова
- (С) n-алмаз, графіт;
- (Si) n кремній;
- (B) n бор


Більшість неметалів мають твердий агрегатний стан.
Сірка – кристалічна речовина жовтого кольору
Червоний фосфор
Вуглець (вугілля)

Неметали малорозчинні у воді
Вугілля
Фосфор
Сірка не змочується водою

- 1. Реагують із металами.
- 2. З киснем.
- 3. З воднем.
- 4. З кислотами.
- 5. З лугами.
- 6. Із солями.
Хіміки розділили всі прості речовини на метали та неметали. Вони сильно розрізняються за будовою, фізичними та хімічними властивостями. Багато хто з них легко відрізнити візуально, наприклад мідь – метал, а бром – неметал. Однак щоб не припуститися помилки при класифікації елементів, краще спиратися на знання чітких ознак, властивих металам і неметал.
Визначення
Елементи, що віддають електрони із зовнішнього енергетичного рівня, називають металами. Метали – це, як правило, тверді речовини (особливо стоїть ртуть, яка за нормальних умов є рідиною).
Елементи, що приймають електрони на зовнішній енергетичний рівень, є неметалами. Вони перебувають у різних агрегатних станах. Кисень і азот - це гази, бром - рідина, а до твердих речовин відносяться, наприклад, миш'як, вуглець і бор.
Порівняння
Всі метали наділені металевим блиском, вони чудові провідники електричного струму та тепла. Більшість їх пластичні, при фізичному впливі метали легко змінюють форму. Неметали, навпаки, погані провідники тепла та електричного струму.
Будова металів та неметалів – головна відмінна характеристика. Неметали – володарі більшої кількості неспарених електронів, які розміщуються зовнішніх рівнях. Метали мають металеві кристалічні грати. А неметалам притаманні молекулярні (наприклад, кисню, хлору і сірці) і атомарні (вуглецю, що утворює алмаз) кристалічні грати.
У металів невелика електронегативність, а отже і окислювально-відновний потенціал невеликий. Вони, як правило, приймають електрони та окислюються, виявляючи відновлювальні властивості. Неметали, наділені великою електронегативністю і значним окислювально-відновним потенціалом, можуть виступати як окислювачі, так і як відновники (таке можливо в присутності найбільш потужного окислювача).
Метали мають дуже цікаву властивість – амфотерність. Амфотерним металам властиві властивості і металів, і неметалів. Наприклад, цинк, перебуваючи у стані вищого ступеня окислення, поводиться як неметал.
Висновки сайт
- у фізичних властивостях.
- У будові атомів.
- У кристалічних ґратах.
- У хімічних властивостях.
- У здатності виявляти окисно-відновні властивості.
- В амфотерності металів.
R - від 1 до 3 е на зовнішньому енергетичному рівні Будова атома: - R - від 1 до 3 е на зовнішньому енергетичному рівні Будова атома: - 2ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ І НЕМЕТАЛІВ АТОМИ класифікують на МеталиНеметали мають Будова атома: - > R - від 1 до 3 е на зовнішньому енергетичному рівні Будова атома: - R - від 1 до 3 е на зовнішньому енергетичному рівні 3 е на зовнішньому енергетичному рівні Будова атома: - R - від 1 до 3 е на зовнішньому енергетичному рівні Будова атома: - R - від 1 до 3 е на зовнішньому енергетичному рівні Будова атома: - title="(!LANG:ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІВ І НЕМЕТАЛІВ АТОМИ класифікують на МеталиНеметали мають Будова атома: - > R - від 1 до 3 е на зовнішньому енергетичному рівні
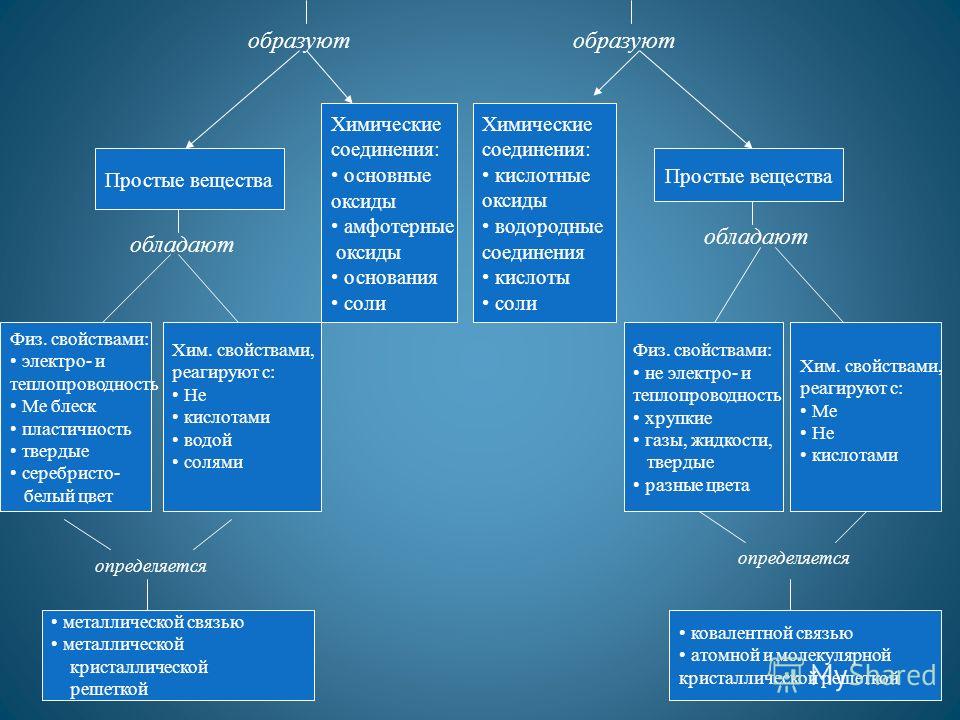
Утворюють Прості речовини Хімічні сполуки: основні оксиди амфотерні оксиди основи солі Хімічні сполуки: кислотні оксиди водневі сполуки кислоти солі Прості речовини мають Фіз. властивостями: електро- та теплопровідність Ме блиск пластичність тверді сріблясто- білий колірХім. властивостями, що реагують з: Не кислотами водою солями Фіз. властивостями: не електро- та теплопровідність крихкі гази, рідини, тверді різні кольориХім. властивостями, що реагують з: Ме Не кислотами металевим зв'язком металевою кристалічною решіткою ковалентним зв'язкоматомною та молекулярною кристалічною решіткою визначається
![]()


Будова: атомна (Si, В), молекулярна (Н 2, N 2, Br 2) Агрегатний стан: – гази – H 2, O 2, O 3, N 2, F 2, Cl 2 ; - Рідина - Br 2; - Тверді речовини - модифікації сірки, фосфору, кремнію, вуглецю та ін Більшість неметалів не електропровідні, мають низьку теплопровідність, а тверді речовини непластичні.
![]()
Алотропія

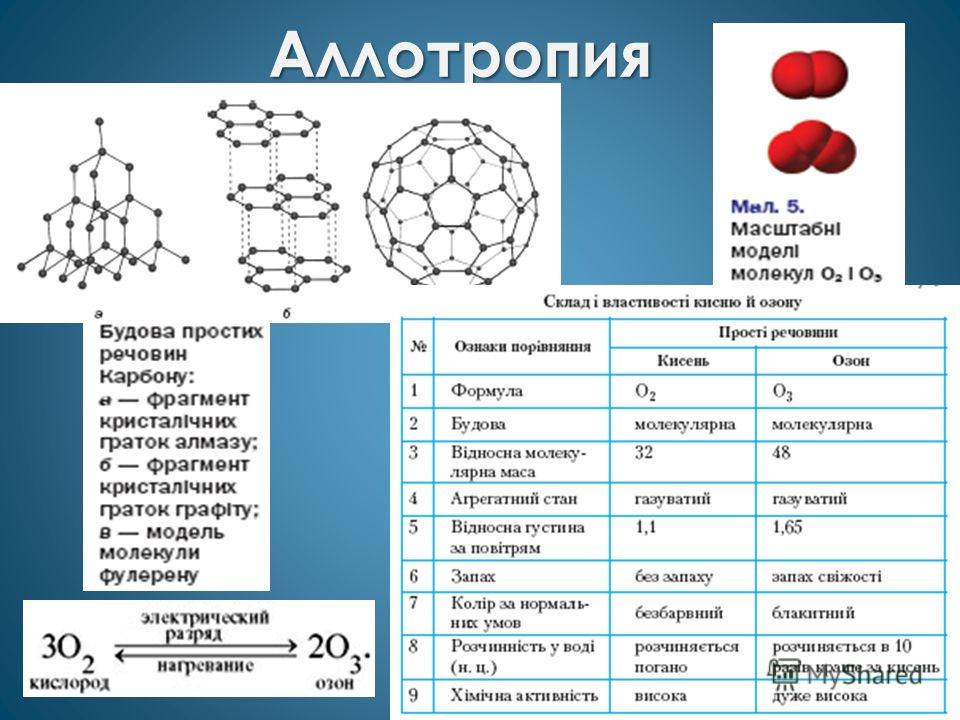
Співвіднесіть: Серед пар речовин вибери «зайву»: а) білий і червоний фосфор; б) кисень і озон; в) кремнезем і кварц; г) алмаз і графіт. Кремній г) Азот Проста речовина 1. мідь2. сірка3. алмаз 4. Білий фосфор Кристалічна решітка А) молекулярна Б) атомна В) металічна

Водневі сполукинеметалів B 2 H 6 диборан CH 4 метан NH 3 аміак H 2 O вода HF фтороводород SiH 4 силан PH 3 фосфін H 2 S сірководень HCl хлороводень GeH 4 герман AsH 3 арсин H 2 Se селеноводород HBr броводень

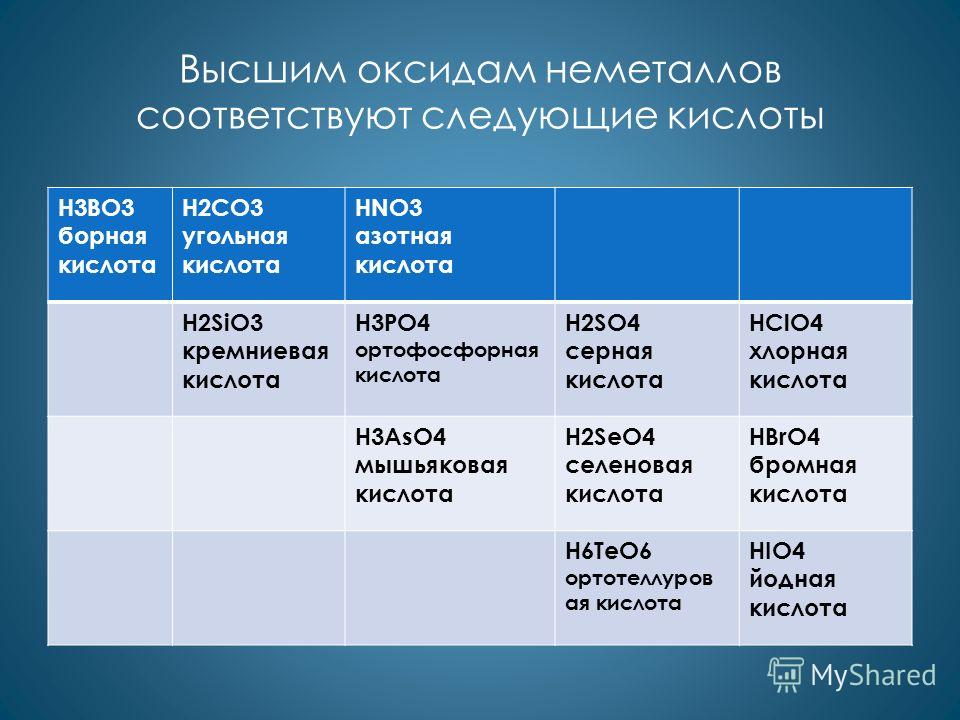
Вищим оксидам неметалів відповідають наступні кислоти H3BO3 борна кислота H2CO3 вугільна кислота HNO3 азотна кислота H3

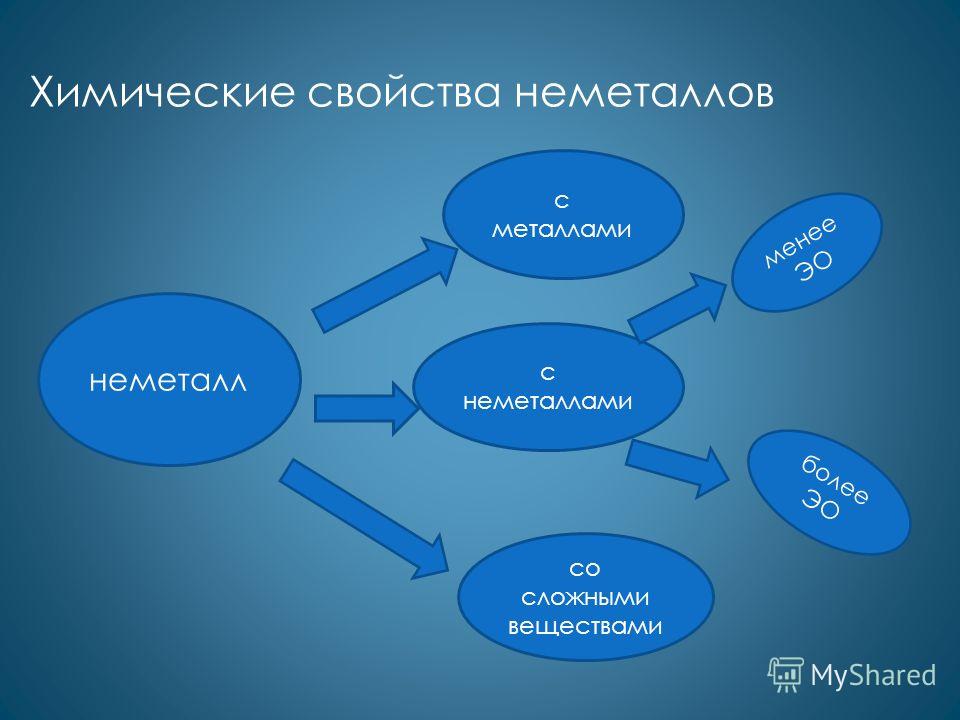
Характерними більшість неметалів є окислювальні властивості. Як окислювачі вони реагують з металами: Ca + Cl 2 = CaCl 2 4Li + O 2 = 2Li 2 O 2Na + S = Na 2 S з менш електронегативними неметалами: H 2 + S = H 2 S P 4 + 5O 2 = 2P 2 O 5 2P + 5Cl 2 = 2PCl 5 зі складними речовинами: 2FeCl 2 + Cl 2 = 2FeCl 3 CH 4 + Br 2 = CH 3 Br + HBr

Менш притаманні неметалів відновлювальні властивості. Як відновники вони реагують з більш електронегативними неметалами: Si + 2F 2 = SiF 4 C + O 2 = CO 2 C + 2S = CS 2 зі складними речовинами: H 2 + HCHO = CH 3 OH 6P + 5KClO 3 = 5KCl + 3P 2 O 5


Речовини Загальні властивості Відмінні властивості Прості речовини – неметали 1. З металами 2. З неметалами 1. Галогени витісняють одна одну з розчинів солей. 2. Кисень реагує зі складними речовинами 3. Вуглець реагує з оксидами металів 4. Вуглець реагує з вуглекислим газом 5. Кремній реагує з розчинами лугів Хімічні властивостінеметалів та деяких з'єднань

РечовиниЗагальні властивостіВідмінні властивості Кислотні оксиди 1. З водою (крім оксиду кремнію) 2. З основними оксидами 3. З лугами 1. Вуглекислий газ і оксид кремнію реагують з магнієм 2. Оксид кремнію реагує з вуглецем 3. Оксид кремнію леткі оксиди Хімічні властивості неметалів та деяких сполук

РечовиниЗагальні властивостіВідмінні властивості Кислоти 1. Змінюють забарвлення індикаторів 2. Реагують з металами 3. Реагують з основними та амфотерними оксидами 4. З основами та амфотерними гідроксидами 5. З солями 1. Плавикова кислота реагує з оксид. реагують з металами 3. При нагріванні розкладаються азотна, вугільна, кремнієва кислоти Хімічні властивості неметалів та деяких сполук

РечовиниЗагальні властивостіВідмінні властивості Солі 1. З розчинами солей 2. З кислотами 3. З лугами 1. При нагріванні розкладаються нітрати, солі амонію, карбонати (крім карбонатів лужних металів) Хімічні властивості неметалів та деяких сполук

