Сам термін "ковалентний зв'язок" походить від двох латинських слів: "со" - спільно і "vales" - має силу, тому що це зв'язок, що відбувається за рахунок пари електронів, що належить одночасно обом (або кажучи більш простою мовою, зв'язок між атомами за рахунок пари електронів, які є спільними їм). Утворення ковалентного зв'язку відбувається виключно серед атомів неметалів, причому вона може з'являтися як в атомах молекул, так і кристалів.
Вперше ковалентна була виявлена в далекому 1916 році американським хіміком Дж. Льюїсом і деякий час існувала у вигляді гіпотези, ідеї, лише потім була підтверджена експериментально. Що з'ясували хіміки з її приводу? А те, що електронегативність неметалів буває досить великою і при хімічній взаємодії двох атомів перенесення електронів від одного до іншого може бути неможливим, саме в цей момент і відбувається об'єднання електронів обох атомів, між ними виникає справжнісінький ковалентний зв'язок атомів.
Типи ковалентного зв'язку
Загалом є два типи ковалентного зв'язку:
- обмінний,
- донорно-акцептні.
При обмінному типі ковалентного зв'язку між атомами кожен із атомів, що з'єднуються, представляє на утворення електронного зв'язку по одному неспареному електрону. При цьому ці електрони повинні мати протилежні заряди (спини).
Прикладом подібного ковалентного зв'язку можуть бути ті, що відбуваються молекулі водню. Коли атоми водню зближуються, у тому електронні хмари проникають друг в друга, у науці це називається перекриттям електронних хмар. Як наслідок, електронна густина між ядрами збільшується, самі вони притягуються один до одного, а енергія системи зменшується. Тим не менш, при надто близькому наближенні ядра починають відштовхуватися, і таким чином виникає певна оптимальна відстань між ними.
Наочно це показано на картинці.

Що ж до донорно-акцепторного типу ковалентного зв'язку, він відбувається коли одна частка, у разі донор, представляє для зв'язку свою електронну пару, а друга, акцептор — вільну орбіталь.
Також говорячи про типи ковалентного зв'язку можна виділити неполярну та полярну ковалентні зв'язки, більш детально про них ми напишемо нижче.
Ковалентний неполярний зв'язок
Визначення ковалентного неполярного зв'язку просто це зв'язок, що утворюється між двома однаковими атомами. Приклад утворення неполярного ковалентного зв'язку дивіться на схемі нижче.
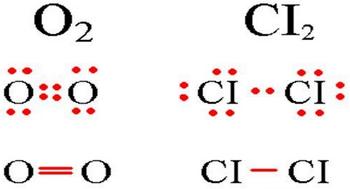
Схема ковалентного неполярного зв'язку.
У молекулах при ковалентному неполярному зв'язку загальні електронні пари розташовуються на рівних відстанях ядер атомів. Наприклад, в молекулі кисню (на схемі вище), атоми набувають восьми електронної конфігурації, при цьому вони мають чотири загальні пари електронів.
Речовинами з ковалентним неполярним зв'язком зазвичай є гази, рідини або порівняно низькоплавні тверді речовини.
Ковалентний полярний зв'язок
Тепер відповімо на запитання який зв'язок ковалентний полярний. Отже, ковалентний полярний зв'язок утворюється, коли ковалентно зв'язані атоми мають різну електронегативність, і суспільні електрони не належать однаково двом атомам. Більшість часу громадські електрони знаходяться ближче до одного атома, ніж до іншого. Прикладом ковалентного полярного зв'язку можуть бути зв'язки, що виникають у молекулі хлороводню, там громадські електрони, відповідальні за утворення ковалентного зв'язку розташовуються ближче до атома хлору, ніж водню. А вся справа в тому, що електронегативність у хлору більша ніж у водню.

Так виглядає схема ковалентного полярного зв'язку.
Яскравим прикладом речовини з полярним ковалентним зв'язком є вода.
Як визначити ковалентний зв'язок
Що ж, тепер ви знаєте відповідь на питання як визначити ковалентний полярний зв'язок, і як неполярний, для цього достатньо знати властивості і хімічну формулумолекул, якщо ця молекула складається з атомів різних елементів, то зв'язок буде полярним, якщо з одного елемента, то неполярним. Також важливо пам'ятати, що ковалентні зв'язки загалом можуть виникати лише серед неметалів, це зумовлено самим механізмом ковалентних зв'язків, описаним вище.
Ковалентний зв'язок, відео
І на завершення відео лекція про тему нашої статті, ковалентний зв'язок.
Ковалентний зв'язок - це хімічний зв'язок, що утворюється за рахунок загальних електронних пар.
Розглянемо механізм утворення ковалентного зв'язку з прикладу молекули водню H2. Атоми водню мають електронну формулу: 1H1s1.
При зближенні двох атомів водню відбувається взаємодія двох електронів з антипаралельними спинами (позначаються електрони стрілками з різних напрямків) із формуванням загальної (поділеної) електронної пари.
Схему утворення ковалентного зв'язку можна уявити, позначаючи неспарений електрон зовнішнього рівня однією точкою, а загальну електронну пару двома точками. Спільну електронну пару, тобто. ковалентний зв'язок, що часто позначають рисою. Загальна електронна пара утворюється в результаті перекриття s-орбіталей атомів водню, при цьому в області перекривання орбіталей створюється підвищена щільність електронна.
Розглянемо утворення ковалентного зв'язку у молекулі хлору Cl2. Атоми хлору мають електронну формулу: 17Cl 1s2 2s2 2p6 3s2 3p5.
Атом хлору має сім електронів на зовнішньому енергетичному рівні, причому на 3p - підрівні знаходиться один неспарений електрон. При зближенні двох атомів хлору відбувається перекриття 3p - орбіталей з неспареними електронами та утворення загальної електронної пари. Кожен атом хлору в молекулі Cl2 зберігає три нерозділені електронні пари (які належать одному атому).
У молекулі водню H2, як і молекулі хлору Cl2, утворюється простий (одинарний) зв'язок. Існують молекули, у яких між двома атомами виникають дві чи три електронні пари. Такі ковалентні зв'язки називають відповідно подвійними або потрійними. Загальна назва подвійних та потрійних зв'язків – кратні зв'язки.
Наприклад, розглянемо утворення ковалентного зв'язку в молекулі кисню O2. Атоми кисню мають електронну формулу: 8 O 1s2 2s2 2p4.
Атом кисню має шість електронів на зовнішньому енергетичному рівні, причому на 2p - підрівні знаходиться два неспарені електрони. В утворенні хімічного зв'язку в молекулі O2 беруть участь по два електрони кожного атома кисню. У разі утворюються дві загальні електронні пари (подвійний зв'язок). Кожен атом кисню в молекулі O2 зберігає дві нерозділені електронні пари.
При утворенні ковалентного зв'язку в молекулі водню кожен з атомів водню є стійкою двоелектронною конфігурацією за рахунок утворення загальної електронної пари. В інших випадках при утворенні ковалентного зв'язку, наприклад, молекулах хлору і кисню кожен з атомів є стійкою конфігурації, що складається з восьми електронів.
У разі всіх трьох розглянутих молекул (водню, хлору та кисню) ковалентний зв'язок утворився між атомами з однаковою електронегативністю. Така взаємодія спостерігається при освіті простих речовин-неметалівмолекули яких складаються з двох однакових атомів І тут загальні електронні пари розташовуються симетрично між ядрами атомів, з'єднуються. Внаслідок цього утворюються молекули, у яких центри позитивних та негативних зарядів збігаються.
Отже, ковалентний зв'язок, який утворюється між атомами з однаковою електронегативністю за рахунок загальних електронних пар, називають ковалентним неполярним зв'язком. Треба запам'ятати, що такий тип хімічного зв'язку утворюється у простих неметалів. Як приклади речовин з ковалентним неполярним типом зв'язку можна назвати фтор F2, бром Br2, йод I2, азот N2.
Якщо атоми, які взаємодіють, мають різну електронегативність (атоми різних хімічних елементів), то загальна електронна пара зміщуватиметься до атома з більшою електронегативністю. При цьому на атомі з більшою електронегативністю формується частковий негативний заряд, а на атомі з меншою електронегативністю - частковий позитивний заряд. Ці часткові заряди за абсолютним значенням менше одиниці.
Наприклад, при утворенні молекули водень хлориду HCl відбувається перекриття s-орбіталі атома водню та p-орбіталі атома хлору. Загальна електронна пара розташована несиметрично щодо центрів атомів, що взаємодіють. Вона зміщується більш електронегативного хлору.
На атомі хлору формується частковий негативний заряд, але в атомі водню — частковий позитивний заряд. І тут у молекулі центри позитивних і негативних зарядів не збігаються. Такі молекули називають полярними або диполями. Диполь — це система двох зарядів, які є однаковими за величиною, але протилежними за знаком.
Отже, ковалентний зв'язок, який утворюється між атомами, електронегативності яких відрізняються, але незначно, називають ковалентним полярним зв'язком. Треба запам'ятати, що такий тип хімічного зв'язку утворюється у складних речовинах, утворених атомами неметалів. Як приклади речовин із ковалентним полярним типом зв'язку можна назвати водень фторид HF, вода H2O, аміак NH3, метан CH4, карбон (IV) оксид CO2.
Для молекули з ковалентним типом хімічного зв'язку можна записати електронну та структурну (графічну) формулу. Електронна формула складається із символів хімічних елементів, навколо яких точками позначені електрони зовнішнього рівня, а між атомами – загальні електронні пари. Структурна (графічна) формула — це формула, де кожна загальна електронна пара зображується рисою. Як електронна, і структурна формули показують порядок повідомлення атомів у молекулі, їх взаємозв'язок.
Ковалентний зв'язок. Полярний та неполярний ковалентний зв'язок
КОВАЛЕНТНИЙ ЗВ'ЯЗОК- це зв'язок, що виникає між атомами за рахунок утворення загальних електронних пар (наприклад, H2, HCl, H2O, O2).
За ступенем зміщення загальних електронних пар до одного із зв'язаних ними атомів ковалентний зв'язок може бути полярним і неполярним.
а) КОВАЛЕНТНИЙ НЕПОЛЯРНИЙ ЗВ'ЯЗОК (КНС)- утворюють атоми одного і того ж хімічного елемента- Неметалла (Наприклад, H2, O2, О3).
Механізм освіти зв'язку.
Кожен атом неметалу віддає в загальне користування іншому атому зовнішні спарені електрони. Утворюються загальні електронні пари. Електронна пара належить однаково обом атомам.
Розглянемо механізм утворення молекули хлору:
Електронна схема утворення молекули Cl2:
Структурна формула молекули Cl2:
σ
Cl - Cl , σ (p - p) - одинарний зв'язок

Розглянемо механізм утворення молекули кисню:
О2 – кнс.
Електронна схема утворення молекули О2:
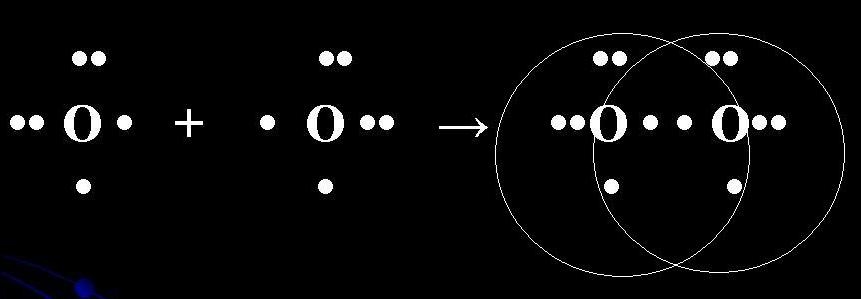
Структурна формула молекули О2:
σ
О = О
π
У молекулі кратний, подвійний зв'язок:
Одна σ (p – p)

та одна π (р – р)
Б) КОВАЛЕНТНИЙ ПОЛЯРНИЙ ЗВ'ЯЗОК (КПС)- утворюють атоми різних неметалів, що відрізняються за значеннями електронегативності (наприклад, HCl, H2O).
Зустрічаються винятки, коли ковалентний зв'язок утворюють атом неметалу та металу!
Наприклад, AlCl3, різниця в електронегативності ∆ Е.О.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
Електронегативність (ЕО) – це властивість атомів одного елемента притягувати до себе електрони від атомів інших елементів. Найбільш електронегативний елемент - фтор F.
Електронегативність можна виразити кількісно і побудувати елементи в ряд за її зростанням. Найчастіше використовують ряд електронегативності елементів, запропонований американським хіміком Л. Полінгом.
Таблиця. Електронегативність (ЕО) деяких елементів (наведено в порядку зростання ЕО).

Механізм освіти зв'язку.
Кожен атом неметалу віддає у загальне користування іншому атому свої зовнішні не спарені електрони. Утворюються загальні електронні пари. Загальна електронна пара зміщена до електронегативнішого елементу.
Розглянемо механізм утворення молекули хлороводню:
НCl – кпс.
Електронна схема утворення молекули НCl:

Ні для кого не секрет, що хімія - наука досить складна і, до того ж, різноманітна. Безліч різних реакцій, реагентів, хімікатів та інших складних та незрозумілих термінів – всі вони взаємодіють один з одним. Але головне, що з хімією ми маємо справу щодня, неважливо, чи слухаємо ми вчителі на уроці і засвоюємо новий матеріал або ж заварюємо чай, який загалом теж є хімічним процесом.
Можна зробити висновок, що хімію знати просто необхідноРозбиратися в ній і знати, як влаштований наш світ або якісь окремі його частини - цікаво, і, більше того, корисно.
Зараз нам належить розібратися з таким терміном, як ковалентний зв'язок, який, до речі, може бути як полярним, так і неполярним. До речі, саме слово «ковалентна», утворюється від латинського «co» - разом і «vales» - має силу.
Поява терміна
Почнемо з того, що сам термін «ковалентна» вперше ввів у 1919 році Ірвінг Ленгмюр.лауреат Нобелівської премії. Поняття «ковалентної» передбачає хімічний зв'язок, при якому обидва атоми мають електрони, що називається спільним володінням. Таким чином, вона, наприклад, відрізняється від металевої, в якій електрони вільні, або від іонної, де і зовсім один віддає електрони іншому. Слід зазначити, що утворюється вона між неметалами.
Виходячи з вищесказаного, можна зробити невеликий висновок про те, що собою являє цей процес. Вона виникає між атомами рахунок утворення загальних електронних пар, причому ці пари виникають на зовнішніх і зовнішніх підрівнях електронів.
Приклади, речовини з полярною:
Види ковалентного зв'язку
Також різняться два види - це полярний, і, відповідно, неполярний зв'язок. Особливості кожної їх ми розберемо окремо.
Ковалентна полярна - освіта
Що являє собою термін «полярна»?
 Зазвичай відбувається так, що два атоми мають різну електронегативність, отже, загальні електрони не належать їм однаково, а знаходяться вони завжди ближче до одного, ніж до іншого. Наприклад, молекула хлороводню, у ній електрони ковалентного зв'язку розташовуються ближче до атома хлору, оскільки його електронегативність вище, ніж у водню. Однак, насправді, різниця в тяжінні електронів невелика настільки, щоб відбулося повне перенесення електрона від водню до хлору.
Зазвичай відбувається так, що два атоми мають різну електронегативність, отже, загальні електрони не належать їм однаково, а знаходяться вони завжди ближче до одного, ніж до іншого. Наприклад, молекула хлороводню, у ній електрони ковалентного зв'язку розташовуються ближче до атома хлору, оскільки його електронегативність вище, ніж у водню. Однак, насправді, різниця в тяжінні електронів невелика настільки, щоб відбулося повне перенесення електрона від водню до хлору.
Через війну при полярної електронна щільність зміщується до більш электроотрицательному, у ньому виникає частковий негативний заряд. У свою чергу, у того ядра, чия електронегативність нижча, виникає відповідно частковий позитивний заряд.
Робимо висновок:полярна виникає між різними неметалами, які відрізняються за значенням електронегативності, а електрони розташовуються ближче до ядра з більшою електронегативністю.
Електронегативність - здатність одних атомів притягувати до себе електрони інших, тим самим утворюючи хімічну реакцію.
Приклади ковалентної полярної, речовини з ковалентним полярним зв'язком:
Формула речовини з ковалентним полярним зв'язком
Ковалентна неполярна, різниця між полярною та неполярною
І нарешті, неполярна, скоро ми дізнаємося що вона з себе представляє.
Основна відмінність неполярної від полярної– це симетрія. Якщо у випадку з полярною електрони розташовувалися ближче до одного атома, то при неполярному зв'язку електрони розташовуються симетрично, тобто в рівній мірі по відношенню до обох.
Примітно, що неполярна виникає між атомами неметалу одного хімічного елемента.
Наприклад, речовини з неполярним ковалентним зв'язком:
Також сукупність електронів часто називають просто електронною хмарою, тому робимо висновок, що електронна хмара зв'язку, яка утворює загальна пара електронів, розподіляється в просторі симетрично, або рівномірно по відношенню до обох ядрів.
Приклади ковалентного неполярного зв'язку та схема утворення ковалентного неполярного зв'язку
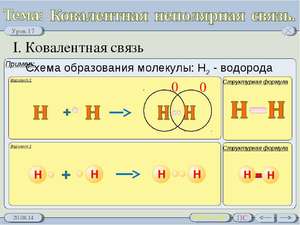
Але також корисно знати, як розрізняти ковалентну полярну і неполярну.
Ковалентна неполярна- це завжди атоми однієї й тієї ж речовини. H2. CL2.
На цьому стаття добігла кінця, тепер ми знаємо, що з себе представляє цей хімічний процес, вміємо визначати його та його різновиди, знаємо формули утворення речовин, і загалом трохи більше про наш складний світ, успіхи в хімії та утворення нових формул.
Типи хімічного зв'язку
Ковалентна: неполярна, полярна, донорно-акцепторна.
Іонна
Металева
Воднева
Ковалентний зв'язок
Ковалентний зв'язок (атомний зв'язок, гомеополярний зв'язок) - хімічний зв'язок, утворений перекриттям (узагальненням) пари валентних електронних хмар. Електронні хмари (електрони), що забезпечують зв'язок, називаються загальною електронною парою.
Простий ковалентний зв'язок утворюється з двох неспарених валентних електронів, на один
від кожного атома:
A · + · В → А: В
В результаті усуспільнення електрони утворюють заповнений енергетичний рівень. Зв'язок утворюється, якщо їх сумарна енергія на цьому рівні буде меншою, ніж у початковому стані (а різниця в енергії буде ні чим іншим, як енергією зв'язку).
Ковалентна неполярна (неметал-неметал)
Якщо атоми, що утворюють простий ковалентний зв'язок, однакові, то справжні заряди атомів у молекулі також однакові, оскільки атоми, що утворюють зв'язок, однаково мають узагальнену електронну пару. Такий зв'язок називається неполярним ковалентним зв'язком. Такий зв'язок мають прості речовини, наприклад О2, N2, Cl2. Але не тільки неметали одного типу можуть утворювати ковалентний неполярний зв'язок. Ковалентний неполярний зв'язок можуть утворювати також елементи-неметали, електронегативність яких має рівне значення, наприклад в молекулі PH3 зв'язок ковалентної неполярної , оскільки ЕО водню дорівнює ЕО фосфору.
Ковалентна полярна (ЕОₐ≠ЕОₓ)
Якщо атоми різні, то ступінь володіння узагальненою парою електронів визначається різницею в електронегативності атомів. Атом з більшою електронегативністю сильніше притягує до себе пару електронів зв'язку, та його справжній заряд стає негативним. Атом з меншою електронегативністю набуває, відповідно, такий самий за величиною позитивний заряд. Якщо з'єднання утворюється між двома різними неметалами, то така сполука називається ковалентним полярним зв'язком .
Донорно-акцепторна
Донорно-акцепторний механізм (інакше координаційний механізм) - спосіб утворення ковалентного хімічного зв'язку між двома атомами або групою атомів, який здійснюється за рахунок неподіленої пари електронів атома-донора та вільної орбіталі атома-акцептора.
Терміни «донорно-акцепторний зв'язок» або «координаційний зв'язок» некоректні, оскільки це не є видом хімічного зв'язку, а лише теоретична модель, що описує особливість її утворення. Властивості ковалентного хімічного зв'язку, утвореного за донорно-акцепторним механізмом, нічим не відрізняються від властивостей зв'язків, утворених за обмінним механізмом (наприклад, зв'язку N-H в іоні амонію NH4+ або зв'язку O-H в іоні гідроксонію Н3O+).
Комплексний неорганічний катіон у сполуках відіграє роль одновалентного металу. Хімічна формула – NH4+. При розчиненні аміаку в розчинах кислот відбувається реакція:
NH3 + H+ = NH4+
^
Гідроксони (оксоній, гідроній) НзО+ - комплексний іон, з'єднання протона з молекулою води.
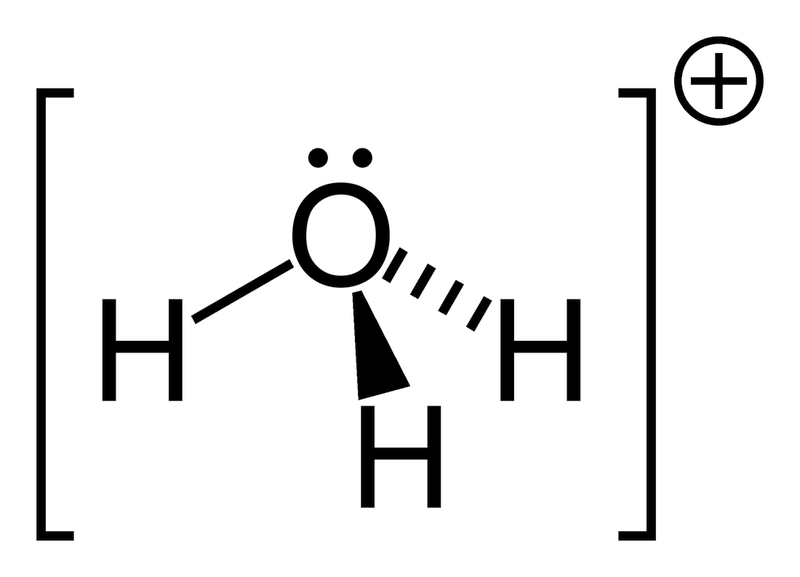
Донорами зазвичай виступають атоми азоту, кисню, фосфору, сірки та інших., мають неподілені електронні пари на валентних орбіталях малого розміру. Роль акцептора можуть виконувати іонізований атом водню H+, деякі p-метали (напр., алюміній при утворенні іона AlH4-) і особливо d-елементи, що мають незаповнені енергетичні осередки у валентному електронному шарі.
Саме з позицій донорно-акцепторного механізму описується утворення локалізованих ковалентних зв'язків у молекулах та молекулярних іонах комплексних (координаційних) сполук: зв'язок формується за рахунок неподіленої пари електронів ліганду та вільної орбіталі атома-комплексоутворювача. Донорно-акцепторний механізм також визначає утворення проміжних продуктів (інтермедіатів) реакції, наприклад, комплексів з перенесенням заряду.
Модель донорно-акцепторного механізму існує лише в рамках уявлень про валентність як локалізація електронної щільності при утворенні ковалентних зв'язків (метод валентних схем). У межах методу молекулярних орбіталей потреби у подібних уявленнях немає.
^
ІІ. Іонний зв'язок (метал-неметал)
Іонний зв'язок - міцний хімічний зв'язок, що утворюється між атомами з великою різницею ( >1,7
за шкалою Полінга) електронегативності, при якій загальна електронна пара повністю переходить до атома з більшою електронегативністю. Це тяжіння іонів як різноіменно заряджених тіл. Прикладом може бути з'єднання CsF, у якому «ступінь іонності» становить 97 %.Розглянемо спосіб освіти з прикладу хлориду натрію NaCl. Електронну конфігурацію атомів натрію та хлору можна уявити: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5
Як це атоми із незавершеними енергетичними рівнями. Вочевидь, їхнього завершення атому натрію легше віддати один електрон, ніж приєднати сім, а атому хлору легше приєднати один електрон, ніж віддати сім. При взаємодії атом натрію повністю віддає один електрон, а атом хлору приймає його. Схематично це можна записати так: Naº - l е -> Na+іон натрію, стійка восьмиелектронна 1s2 2s2 2p6 оболонка за рахунок другого енергетичного рівня.
Clº + 1е → Cl¯- іон хлору, стійка восьмиелектронна оболонка. Між іонами Na+ і Cl- виникають сили електростатичного тяжіння, у результаті утворюється з'єднання. Іонний зв'язок – крайній випадок поляризації ковалентного полярного зв'язку. Утворюється між типовими металом та неметалом.
При цьому електрони у металу повністю переходять до неметалу. Утворюються іони – заряджені частки.
Якщо хімічний зв'язок утворюється між атомами, які мають дуже велику різницю електронегативностей (ЕО > 1.7 за Полінгом. Таблиця ЕО представлена нижче), то загальна електронна пара повністю переходить до атома з більшою ЕО. Результатом цього є утворення з'єднання протилежно заряджених іонів:
Між іонами, що утворилися, виникає електростатичне тяжіння, яке називається іонним зв'язком. Точніше, такий погляд зручний. Насправді іонний зв'язок між атомами в чистому вигляді не реалізується ніде або майже ніде, зазвичай насправді зв'язок носить частково іонний, а частково ковалентний характер. У той самий час зв'язок складних молекулярних іонів часто можна вважати чисто іонної. Найважливіші відмінності іонного зв'язку з інших типів хімічного зв'язку полягають у ненаправленности і ненасыщаемости. Саме тому кристали, утворені за рахунок іонного зв'язку, тяжіють до різних щільних упаковок відповідних іонів.
Характеристикою подібних сполук є хороша розчинність у полярних розчинниках (вода, кислоти тощо). Це відбувається через зарядженість елементів молекули. При цьому диполі розчинника притягуються до заряджених кінців молекули, і, в результаті Броунівського руху, «розтягують» молекулу речовини на частини та оточують їх, не даючи знову з'єднатися. У результаті виходять іони оточені диполями розчинника. 
^ Металевий зв'язок
Металевий зв'язок – хімічний зв'язок, зумовлений наявністю щодо вільних електронів. Характерна як для чистих металів, так і для їх сплавів та інтерметалевих сполук.
Механізм металевого зв'язку
У всіх вузлах кристалічних ґрат розташовані позитивні іони металу. Між ними безладно, подібно до молекул газу рухаються валентні електрони, що відчепилися від атомів при утворенні іонів. Ці електрони грають роль цементу, утримуючи разом позитивні іони; в іншому випадку грати розпалися б під дією сил відштовхування між іонами. Разом з тим і електрони утримуються іонами в межах кристалічних ґрат і не можуть її покинути. Сили зв'язку не локалізовані та не спрямовані. Тому здебільшого виявляються високі координаційні числа (наприклад, 12 чи 8).
Більшість металів утворює одну з наступних високосиметричних ґрат із щільною упаковкою атомів:
кубічну об'ємно центровану, кубічну гранецентровану та гексагональну.
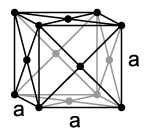
У кубічних об'ємно центрованих гратах (ОЦК) атоми розташовані у вершинах куба і один атом в центрі об'єму куба. Кубічні об'ємно центровані грати мають метали: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba та ін.

У кубічних гранецентрованих гратах (ГЦК) атоми розташовані у вершинах куба і в центрі кожної грані. Решітки такого типу мають метали: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co та ін.
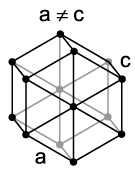
У гексагональній решітці атоми розташовані у вершинах та центрі шестигранних основ призми, а три атоми – у середній площині призми. Таку упаковку атомів мають метали: Mg, -Ti, Cd, Re, Os, Ru, Zn, -Co, Be, -Ca та ін.
Властивості
Електрони, що вільно рухаються, обумовлюють високу електро- і теплопровідність. Речовини, що мають металевий зв'язок, часто поєднують міцність з пластичністю, так як при зміщенні атомів один щодо одного не відбувається розрив зв'язків.
^
IV. Водневий зв'язок
Водневий зв'язок- форма асоціації між електронегативним атомом та атомом водню H, пов'язаним ковалентно з іншим електронегативним атомом. Як електронегативні атоми можуть виступати N, O або F. Водневі зв'язки можуть бути міжмолекулярними або внутрішньомолекулярними.
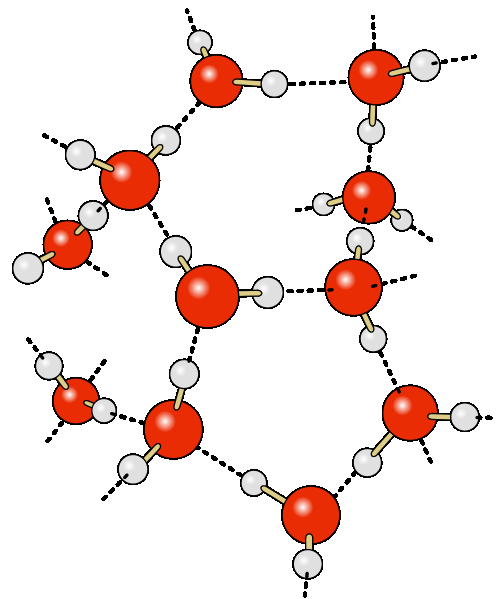
Часто водневий зв'язок розглядають як електростатичну взаємодію, посилену невеликим розміром водню, що дозволяє близькість взаємодіючих диполів. Тоді про це говорять як про різновид донорно-акцепторного зв'язку, невалентну взаємодію між атомом водню H, ковалентно пов'язаним з атомом A групи A-Hмолекули RA-H та електронегативним атомом B іншої молекули (або функціональної групи тієї ж молекули) BR". Результатом таких взаємодій є комплекси RA-H BR" різного ступеня стабільності, в яких атом водню виступає в ролі «мосту», що зв'язує фрагменти RA і BR".
Особливостями водневого зв'язку, за якими її виділяють у окремий вигляд, є її не дуже висока міцність, її поширеність і важливість, особливо в органічних сполуках, а також деякі побічні ефектипов'язані з малими розмірами та відсутністю додаткових електронів у водню.
Енергія водневого зв'язку значно менше енергії звичайного ковалентного зв'язку (не перевищує 40 кДж/моль). Однак цієї енергії достатньо, щоб викликати асоціацію молекул, тобто їхнє об'єднання в димери або полімери. Саме асоціація молекул спричиняє аномально високих температурплавлення та кипіння таких речовин, як фтороводород, вода, аміак.
Зв'язок цього типу, хоч і слабкіший за іонний і ковалентний зв'язки, проте, відіграє дуже важливу роль у внутрішньо- і міжмолекулярних взаємодіях. Водневі зв'язки багато в чому зумовлюють Фізичні властивостіводи та багатьох органічних рідин (спирти, карбонові кислоти, аміди карбонових кислот, складні ефіри).
Аномально висока теплоємність води, і навіть теплопровідність багатоатомних спиртів забезпечується численними водневими зв'язками. Одна молекула води може утворити до чотирьох класичних водневих зв'язків із сусідами.
Водневі зв'язки підвищують температуру кипіння, в'язкість та поверхневий натяг рідин. Водневі зв'язки відповідальні за багато інших унікальних властивостей води.
Згідно з сучасними уявленнями, наявність водневих зв'язків між молекулами води призводить до виникнення так званих водних кластерів або комплексів. Найпростішим прикладом такого кластера може бути димер води:
вода є мережею молекул H2O, з'єднаних водневими зв'язками.

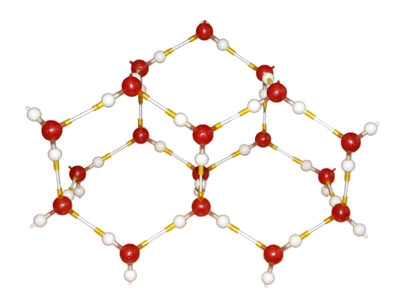
При замерзанні води утворюється багато водневих зв'язків:
![]()
Водневі зв'язки в молекулах льоду:
Водневі зв'язки між молекулами органічних кислот:

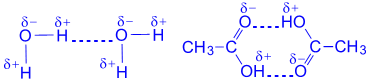
Водневі зв'язки у білках:

