تروياندي بودوفا والسلطةخطابات بسيطة
غير المعادن.
معظم أنواع اللافلزات هي معادن جزيئية، وعدد أقل من الأنواع غير جزيئية. وهذا ما يفسر غطرسة سلطاتهم.هذا موضح بوضوح في المخطط 2. كلمات بسيطة من المعادن غير الجزيئية إلى المعادن الجزيئية C، B، SiF2، O2، Cl2، Br2، N2، I2، S8 هذه اللافلزات لها شبكات بلورية ذرية، لذلك فهي تتمتع بصلابة كبيرة و درجة حرارة انصهار عالية جدا
تحتوي هذه اللافلزات على نتوءات بلورية جزيئية في الحالة الصلبة.
في
ولذلك، فإن استخلاص الإلكترونات يمكن أن يؤدي إلى ثلاثة مسارات مختلفة.
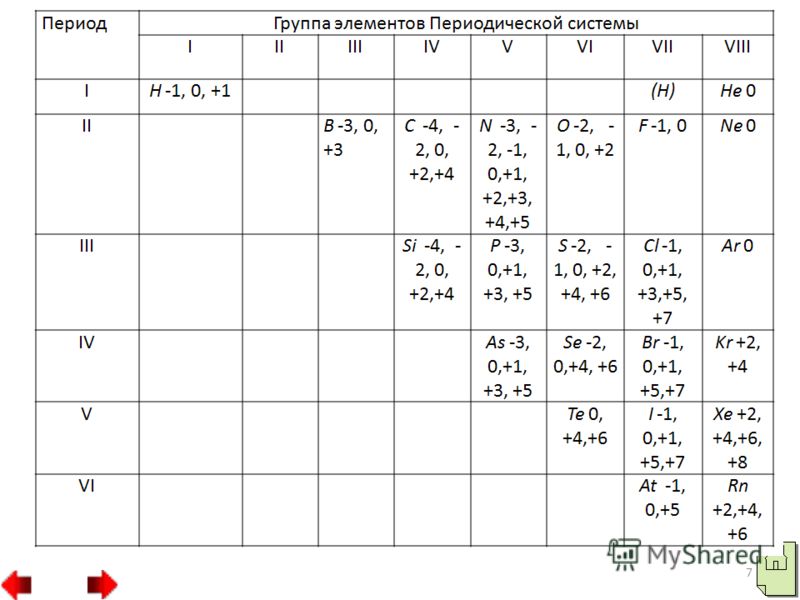
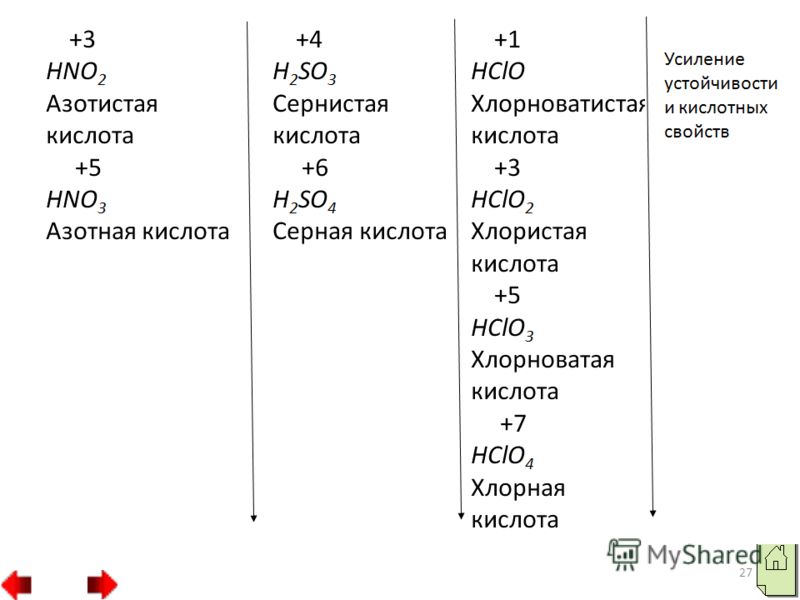
في المرحلة الأولى، يمكن للكلور أن يكشف مرحلة الأكسدة 3 وينتج حمض الكلوروس HClO2، والذي يتمثل بأملاح الكلوريت، على سبيل المثال، كلوريت البوتاسيوم KClO2.
وفي حالات أخرى يمكن للكلور القضاء على التفاعلات التي تكون فيها مرحلة أكسدة الكلور 5. وقبل مثل هذه التفاعلات يضاف حمض الكلوريك HClO3 وأملاح الكلورات، مثل طمي كلورات البوتاسيوم KClO3 بيرثوليت.
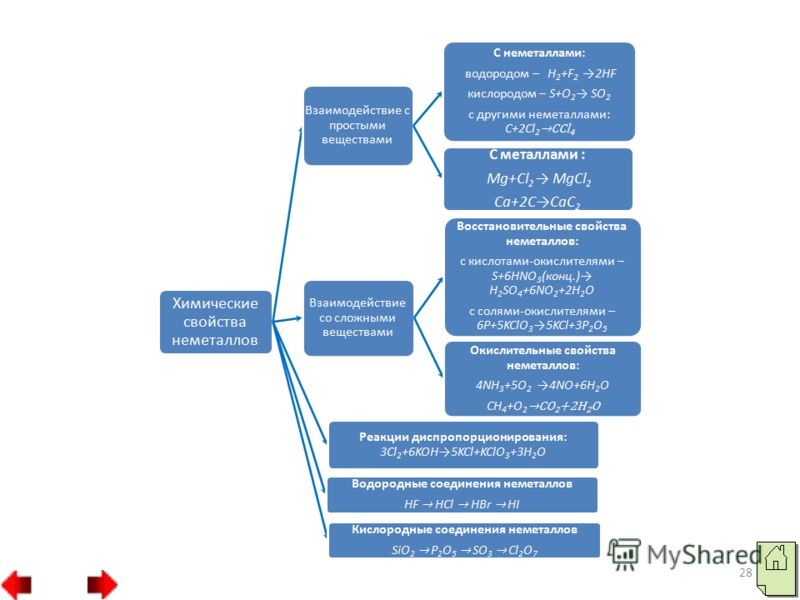
وفي النوع الثالث، يظهر الكلور مرحلة الأكسدة 7، على سبيل المثال، في حمض البيركلوريك HClO4 وفي أملاحه فوق كلورات، على سبيل المثال، في بيركلورات البوتاسيوم KClO4. 4. الأجزاء المصبوغة والمائية من اللافلزات.وصف موجز لسلطاتهم. أكاسيد غير معدنية تذيب الأكاسيد الحمضية.وفي بعض الأكاسيد تظهر الرائحة النتنة مرحلة أكسدة قصوى تساوي رقم المجموعة مثلا SO2, N2O5، وفي أخرى مستوى أقل مثلا SO2, N2O3.
يتم تمثيل الأكاسيد الحمضية بالأحماض، ومن بين حمضين حمضيين يكون حمض غير معدني أقوى من الحمض الذي يظهر فيه النبيذ مرحلة أكسدة أعلى.
مع اللافلزات، يخلق الماء ثقوبًا في البنية الجزيئية.
أعظم العقول لديها الكثير من الحياة.
خلال فترات الطاقة الحمضية اليسرى لمياه الصيف، ستصبح أشباه المعادن غير المعدنية في مناطق المياه أقوى.
أي أنها تنتج أبخرة إلكترونات حامضة، وتشكل مدارًا حرًا، وتحدث عملية تبدو كالتالي: H2O HF H3O F فلوريد الهيدروجين في محلول مائي يقسم الأيونات الموجبة للماء، ثم.
يكشف عن القوة الحمضية.
تخضع هذه العملية لشروط مختلفة: للحمض زوج إلكترون وحيد، وللماء مدار حر، ولهذا السبب يتم إنشاء رابطة بين المانح والمستقبل.
عند استنفاد الأمونيا في مياه الشرب، تحدث عملية طويلة.
تعطي الشظايا النيتروجين زوجًا إلكترونيًا وحيدًا، وتشكل مدارًا حرًا، وتشكل رابطة إضافية وتنتج أيونات الأمونيوم NH4 وأيونات الهيدروكسيد VIN.
يمكن التعبير عن هذه العملية بالصيغة H2O NH3 NH4 OH حيث تضيف جزيئات الأمونيا المائية أيونات موجبة إلى الماء.
أمياك يكشف عن القوة الرئيسية.
الآن دعونا نلقي نظرة على سبب اتحاد الماء للفلور مع فلوريد الهيدروجين HF في الماء مع حمض، وحمض ضعيف، وكلوروهيدروجين أقل.
2 اللافلزات هي عناصر كيميائية تستقبل ذراتها الإلكترونات بسهولة من مستوى الطاقة الخارجي، مما يؤدي إلى تكوين أيونات في شحنتها السالبة. وتذوب العناصر غير المعدنية في نهاية الفترات وتشكل تكوينًا إلكترونيًا للكرة الخارجية، قريبًا أو مساويًا لتكوين أقرب غاز خامل.تقريبًا جميع المعادن غير المعدنية تتأرجح بأنصاف أقطار صغيرة بشكل متساوٍ، وهو ما يميزها
قيم عالية السالبية الكهربية وأكاسيد الطاقة. 3. من بين اللافلزات، يتم إحضار عنصرين، الماء والهيليوم، إلى الموطن، وكل العناصر الأخرى توضع إلى الموطن. توجد في كرة الإلكترون الخارجية ذرات من اللافلزاتمقاس

4
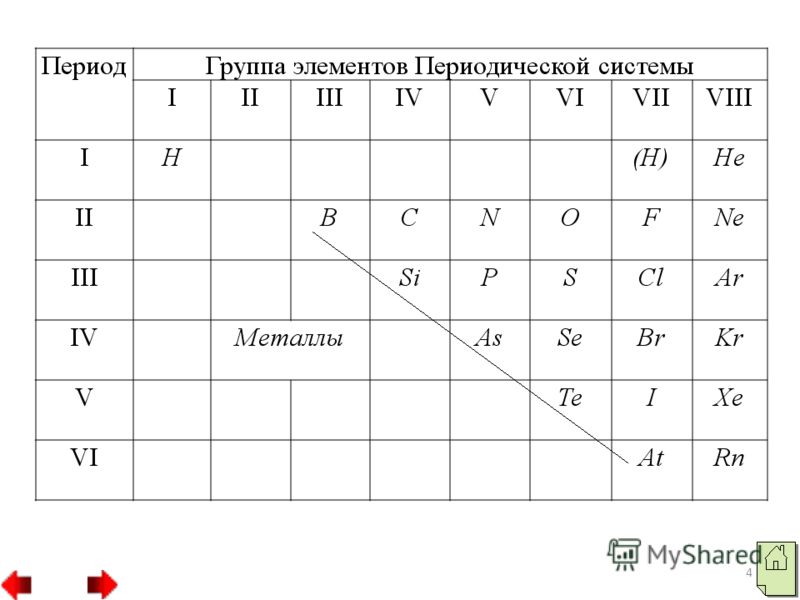
5

6
7
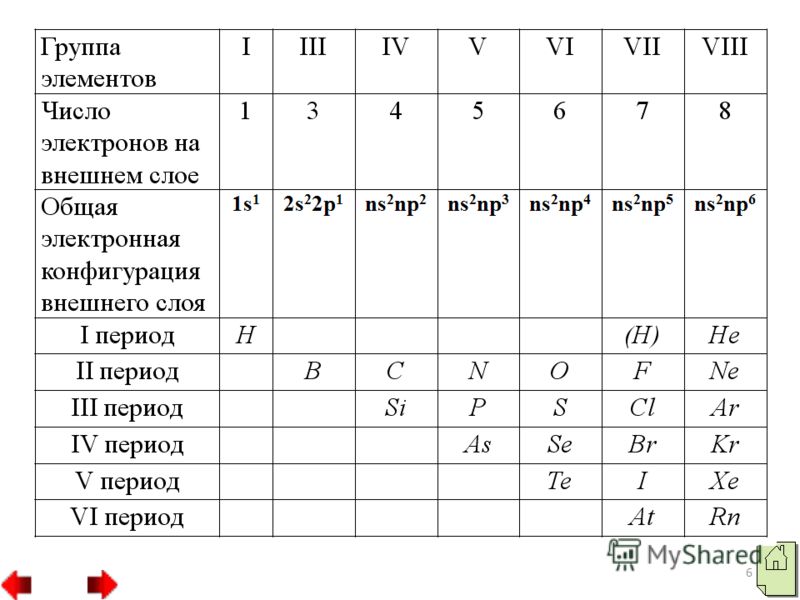
الإلكترونات: تحتوي ذرة الماء على إلكترون واحد (1s)، وذرة الهيليوم تحتوي على إلكترونين، وذرة البورون لديها ثلاثة إلكترونات. وتمتلك ذرات البروتين في معظم اللافلزات، باستثناء ذرات المعادن، مقاييس كبيرة على كرة الإلكترون الخارجية. الكهرباء من 4 إلى 8. يتم إنشاء جميع اللافلزات الناطقة من ذرات مرتبطة ببعضها البعض بواسطة تساهمية

9

اتصال غير قطبي .يمكن أن تشبه الرائحة الكريهة جزيئات الماء والحامض والنيتروجين والماء الذري، مثل بلورات الألماس أو البورون. 8 دور اللافلزات في الطبيعة أكبر.وبلغت نسبة اللافلزات 84% من كتلة التربة، و98.5% من كتلة التربة، و97.6% من كتلة جسم الإنسان. ستة معادن غير معدنية: الكربون والماء والحامض والنيتروجين والفوسفور والكبريت هي عناصر عضوية، يتم تضمين شظاياها في تكوين جزيئات البروتينات والدهون والكربوهيدرات والأحماض النووية.وفقا لنا، هناك خليط من المركبات البسيطة والمعقدة التي يتم إنشاؤها باستخدام اللافلزات (الأكسجين والنيتروجين وثاني أكسيد الكربون).

11


13


15 تتميز إمدادات المياه من المواد غير المعدنية بإعدادات مختلفة للمياه.

يتفكك الميثان والسيلان بشكل سيئ في الماء. الأمونيا والفوسفين، عند إذابتهما في الماء، يذيبان القواعد الضعيفة - هيدروكسيد الأمونيوم NH 4 OH وهيدروكسيد الفوسفونيوم pH 4 OH.عندما تذوب في الماء والماء والسيلينيوم والماء، وكذلك الماء المهلجن، يتم إنشاء أحماض لها نفس الصيغة مثل الماء نفسه.



16 وفي فترات الشر إلى اليمين تقوى قوة حمضية مياه الصيف وأشباه المعادن في أقسام المياه، وتضعف الجماعات.

النشاط التأكسدي



vodnevih spoluk

تختلف المواد غير المعدنية في المجموعات من الأعلى إلى الأسفل بشكل كبير.

HF حمض الهيدروكلوريك HBr مرحبا

26 في المجموعات الفرعية الرئيسية تضعف الخواص الحمضية للأكاسيد اللافلزية، وفي فترات الزيادة إلى اليمين: SiO 2 P 2 O 5 SO 3 Cl 2 O 7 تقوية الخواص الحمضية لجميع الأكاسيد الحمضية بما في ذلك السيليكون ( II) أكسيد SiO 2 ، يتم معاقبة في الماء، وهيدرات مهدئة من الأكاسيد، والتي هي بطبيعتها الأحماض:

27
28


31 2. يمكن استبدال الصفقات غير المعدنية بالترقيات. على سبيل المثال، تتم إزالة الفوسفور والأمياك والسورما والتفحم بالكربون المحدث: 3.الطرق الفيزيائية

32
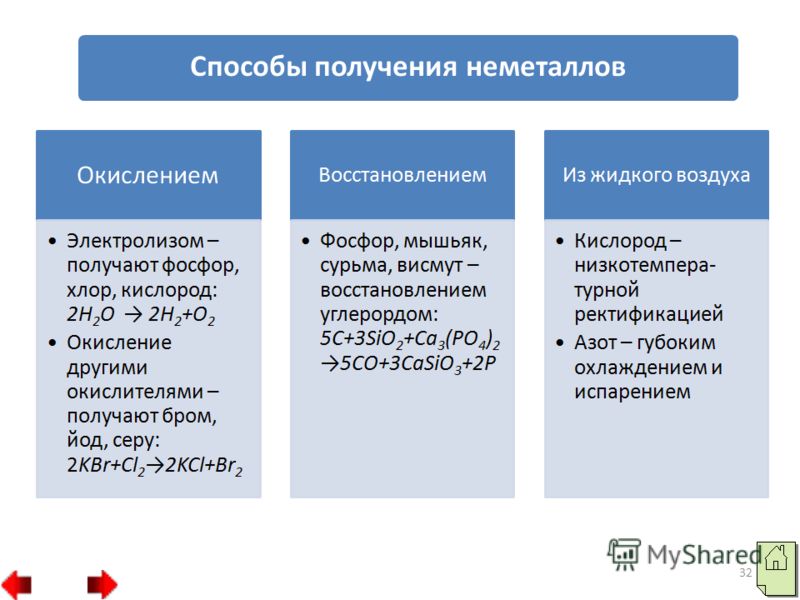
: أ) تصحيح درجات الحرارة المنخفضة - هذه هي الطريقة للحفاظ على كيسن من الريح؛

ب) التبريد العميق والتبخر - وذلك للاحتفاظ بالنيتروجين من السطح 33 مصدر الطاقة 1. ما هي مجموعات وفترات النظام الدوري للعناصر الكيميائية لـ D.I Mendelev التي تحتوي على عناصر غير معدنية؟ 2. ما هي اللافلزات التي تشكل الشبكة البلورية الذرية، وما هي الجزيئية وما الذي يوجد في مظهر الذرات الصلبة؟

3. ما هي اللافلزات النادرة عند درجة حرارة 20 درجة مئوية، وما هي اللافلزات التي تكون غازات، وما هي المواد الصلبة؟
4. كيف تتغير الخصائص غير المعدنية للعناصر في جدول D.I Mendeleev خلال فترات التغيير إلى اليمين وفي المجموعات الفرعية الرئيسية من الأسفل إلى الأسفل؟ 34 5. حدد العناصر التي تتأكسد والتي تتجدد في تفاعلات المركبات البسيطة: أ) S + O 2 = SO 2؛- ب) S + 2Cl 2 = SCl 4؛
ج) Cl 2 + H 2 = 2HCl؛
د) 2P + 3Br 2 = 2PBr تتفاعل اللافلزات مع الأحماض المؤكسدة، وتتحول إلى أحماض أو أكاسيد حمضية خطوات طويلة أكسدة أضف مستوى التفاعلات الأولية: أ) C + H 2 SO 4 (conc.) = b) C + HNO 3 (conc.) = c) S + HNO 3 (conc.) =- زيمونينا ليودميلا بافليفنا
- كرر مفاهيم السالبية الكهربية (EO) والتباين.
- أنا
- نصف القطر الذري صغير (يتماشى مع نصف قطر ذرات المعدن في إحدى فتراتها).
- نوع معين من العناصر غير المعدنية هو السالبية الكهربية (افهم مفهوم السالبية الكهربية، عدد السالبية الكهربية).
- أكاسيد الحرارة.
- كلما اقترب العنصر من PS الذي يتحول إلى الفلور، ظهرت أكاسيد أقوى فيه.
- أما بالنسبة لللافلزات - أبسط الخطابات - فهي تتميز أكثر بخضوعها للسلطة (الفيزيائية والكيميائية)، وانخفاض قوتها.
- يتم تفسير تنوع قوى اللافلزات من خلال حقيقة أن اللافلزات يمكن أن تنتج نوعين من الفلزات البلورية: الجزيئية (جميع الغازات والفوسفور الأبيض والكبريت واليود) والذرية (البورون والسيليكون البلوري والماس والجرافيت).
- القوة الجسدية للخطب البسيطة – غير المعادن.تتميز اللافلزات (الكلام البسيط) بجميع مراحل التجميع الثلاثة للعقول الأساسية (لكي تكون واضحًا - جميع المعادن، باستثناء الزئبق، في العقول المتطرفة لديها كلام قوي).
| المواد الصلبة: تعديلات مختلفة من الكبريت، واليود البلوري، والجرافيت، والفوسفور، والهبة النشطة، والسيليكون البلوري أو غير المتبلور، والبير. | ||
| مستودع الجزيئات | ||
| القوة البدنية | غاز، ليس له لون ولا طعم ولا رائحة، سيء في الماء، وفي حالات نادرة يكون لونه أزرق فاتح، وفي المواد الصلبة يكون أزرق. درجة حرارة الانصهار -218.7 0 درجة مئوية درجة حرارة الغليان -183 0 درجة مئوية | غاز أزرق فاتح، سائل أزرق غامق، بنفسجي غامق في الحالة الصلبة، له رائحة قوية، أكثر إشراقا 10 مرات في الحالة، قليل الحموضة، مر في الماء. درجة حرارة الانصهار -193 0 درجة مئوية درجة حرارة الغليان -112 0 درجة مئوية |
| القوة الكيميائية | مؤكسد قوي 2Cu + O 2 = 2CuO 2PbS + 3O 2 = 2PbO + 2SO 2 | كعامل مؤكسد أقوى، تشكل الأجزاء جزيئًا غير مستقر 3PbS + 4O 3 = 3PbSO 4 2Ag + O 3 = Ag 2 O + O 2 2KI + O 3 + H 2 O = I 2 + 2KOH + O 2 |
- القوة الكيميائية لللافلزات
