مصطلح "الرابط التساهمي" في حد ذاته يشبه كلمتين لاتينيتين: "من" - spilno و "vales" - لدي قوة ، لذلك ، بالنسبة إلى صوت الأجراس ، وكيفية استخدام زوج من الإلكترونات ، وكيفية الاستلقاء لمدة ساعة واحدة بلدي ، حلقة بين الذرات لراخونوك من زوج من الإلكترونات ، مثل є spilnyh їm). تم العثور على إنشاء الرابط التساهمي فقط بين ذرات اللافلزات ، ويمكن العثور عليها في ذرات الجزيئات ، وكذلك في البلورات.
لأول مرة ، تم الكشف عن الكرة التساهمية في عام 1916 البعيد بواسطة الكيميائي الأمريكي جيه لويس ، ولمدة ساعة واحدة ، حُرمت الأفكار والأفكار من الأفكار المؤكدة تجريبياً. كيف ذهب الكيميائيون إلى محرك الأقراص؟ وهؤلاء ، أن القدرة الكهربية غير الفلزية ستصل إلى الحد الأقصى وعندما يتم نقل الترابط الكيميائي للذرتين ، فإن الإلكترونات من واحدة إلى الأخيرة قد تكون غير حكيمة ، ففي اللحظة ذاتها تحتاج الذرة إلى أن تكون مترابط معهم.
رابط تساهمية تيبي
Zagalom نوعان من الارتباط التساهمي:
- أوبميني
- قبول المتبرع.
عندما يتم تبادل نوع الارتباط التساهمي بين ذرات الجلد والذرات التي يمكن إزالتها ، يتم تقديمه للرابط الإلكتروني لإلكترون واحد غير مزدوج. مع وجود الكثير من الأجهزة الإلكترونية ، تكون الأم مسؤولة عن الشحن المضاد (للخلف).
مع إضافة رابط تساهمية مماثل ، يمكن استخدام الرابط لنقل جزيئات الماء. إذا اقتربت الذرات ، تخترق الابتسامات الإلكترونية بعضها البعض ، يُطلق على النوتسي إعادة تكوين الابتسامات الإلكترونية. ميراث الياك ، النشوة الإلكترونية بين النوى تنمو ، تنجذب الرائحة الكريهة نفسها من شخص إلى آخر ، وتتغير طاقة النظام. تيم ليس أقلها ، مع قربه الشديد من النوى ، يمكنهم إصلاح النتائج ، وبهذه المرتبة من الأفضل رؤيتها بينهم.
هو مبين في الواقع في الصورة.

قبل نوع الارتباط التساهمي المتلقي للمانح ، إذا تم توصيل جزء واحد ، يقدم المتبرع الزوج الإلكتروني الخاص به للرابط ، والمقبل - مدار افتراضي للرابط.
عند الحديث أيضًا عن نوع الارتباط التساهمي ، يمكنك رؤية الروابط التساهمية غير القطبية والقطبية ، ومزيد من التفاصيل عنها مكتوبة أدناه.
رابط تساهمية غير قطبية
إن قيمة الارتباط التساهمي غير القطبي هو ببساطة رابط يتم إنشاؤه بين ذرتين متطابقتين. إن تطبيق الارتباط التساهمي غير القطبي مذهول من الرسم البياني أدناه.
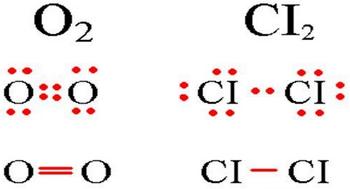
رسم تخطيطي للوصلة التساهمية غير القطبية.
في الجزيئات ذات الارتباط التساهمي غير القطبي ، تبدأ الرهانات الإلكترونية الخارجية في الانكماش في الجوانب البعيدة لنواة الذرات. على سبيل المثال ، في الحموضة الجزيئية (على الرسم التخطيطي) ، تمتلئ الذرات بثمانية تكوينات إلكترونية ، مع الرائحة الكريهة الكاملة قد يكون هناك اختيار من الأزواج الإلكترونية.
مع الأنهار ذات الحلقة التساهمية غير القطبية ، أو الغاز الصرير ، أو أحيانًا الكلام الصلب منخفض الانصهار.
الارتباط القطبي التساهمي
الآن رابط القطبية التساهمية متاح لإمداد الطاقة. مرة أخرى ، يتم إنشاء الرابط القطبي التساهمي ، إذا كانت الذرات المرتبطة تساهميًا قد لا تكون سالبة كهربائيًا ، ولا تتداخل الإلكترونات المعلقة مع ذرتين. لأكثر من ساعة ، كانت الإلكترونيات الضخمة أقرب إلى ذرة واحدة ، وليس إلى آخرها. مع إضافة الارتباط القطبي التساهمي ، يمكن أن تكون هناك روابط موجودة في جزيئات ماء الكلور ، وهناك إلكترونات ضخمة ، استجابة لإنشاء رابط تساهمية ، للتوسع أقرب إلى ذرة الكلور ، انخفاض الماء. وكل ما على اليمين هو أن الكلور سالب كهربائيًا أكثر من الماء.

مخطط vigleadє للرابط القطبي التساهمي.
دعونا نخدش مؤخرة الكلام بوصلة تساهمية قطبية - ماء.
الياك مع الارتباط التساهمي
حسنًا ، أنت الآن تعرف كيف تأكل لأن هناك علاقة تساهمية قطبية ، باعتبارها غير قطبية ، لكل نبل القوة و صيغة الكيمياءالجزيئات ، إذا تطوى الجزيء إلى ذرات من عناصر مختلفة ، فسيكون الارتباط قطبيًا ، مثل عنصر واحد ، فسيكون غير قطبي. من المهم جدًا أن نتذكر أن الروابط التساهمية يمكن أن تضيع من وسط اللافلزات ، نظرًا لآلية الروابط التساهمية ذاتها ، سنصفها.
رابط تساهمية ، فيديو
في نهاية محاضرة الفيديو حول موضوع نظامنا الأساسي الرابط التساهمي.
الرابط التساهمي هو سلسلة من الروابط الكيميائية ، والتي يمكن أن تتظاهر بأنها راخون من الأزواج الإلكترونية البعيدة.
آلية إنشاء رابط تساهمية من مؤخرة جزيء H2 مرئية بوضوح. يمكن إيجاد الذرات باستخدام الصيغة الإلكترونية: 1H1s1.
عندما تقترب ذرتان من بعضهما البعض ، فإن إلكترونين مترابطين مع دوران مضاد للتوازي (يُعرف بالسهام الإلكترونية من اتجاهات مختلفة) من شكل رهان إلكتروني متخلف (مقسم جزئيًا).
يمكن إظهار مخطط إنشاء رابط تساهمية عن طريق عدم اقتران الحلقة الإلكترونية بنقطة واحدة ، والاتصال الإلكتروني بنقطتين. زوجين الإلكترونية Spilnu ، tobto. الارتباط التساهمي ، والذي يرتبط غالبًا بالأرز. يتم إنشاء الزوج الإلكتروني الأولي نتيجة التواء المدار s للذرات في الماء ، بينما في منطقة التواء المدار ، تتغير الإلكترونيات.
يمكن رؤية إنشاء الرابط التساهمي في جزيء الكلور Cl2 بوضوح. قد يكون لذرات الكلور صيغة إلكترونية: 17Cl 1s2 2s2 2p6 3s2 3p5.
يمكن العثور على ذرة الكلور في المستوى الأكثر نشاطًا ، وعند 3 نقاط - عادة ما يكون هناك إقران واحد للإلكترونات. عندما تقترب ذرتان من الكلور ، يتم عرض تقاطع 3p - يدور مع إلكترونات غير مقترنة ويتم إنشاء رهان إلكتروني غريب. تحتوي ذرة الكلور الموجودة في جزيء Cl2 على ثلاث رهانات إلكترونية غير مدمرة (تقع على ذرة واحدة).
جزيئات الماء H2 ، وكذلك جزيئات الكلور Cl2 ، لها رابط بسيط (منفرد). الجزيئات ، التي فيها ذرتان ، هناك ثلاث رهانات إلكترونية. تسمى هذه الروابط التساهمية بالمرؤوس أو المرؤوس. الاسم الأولي للروابط الفرعية والثانوية هو روابط متعددة.
على سبيل المثال ، من الواضح أن الارتباط التساهمي في جزيء O2 محدد بوضوح. الذرات يمكنني كتابة صيغة إلكترونية: 8 O 1s2 2s2 2p4.
Atom ، يوجد الكثير من الإلكترونات على المستوى الأكثر كفاءة في استخدام الطاقة ، وفي 2p يوجد إلكترونان غير متزاوجين. في الارتباط الكيميائي الراسخ في جزيء O2 ، يشارك إلكترونان من ذرات الجلد. هناك نوعان من الرهانات الإلكترونية (رابط فرعي) في وقت واحد. تكون ذرة الجلد حامضة في جزيء O2.
عندما يتم إنشاء ارتباط تساهمي في جزيء الجلد مع الذرات في تكوين واحد من إلكترونين لإنشاء رهان إلكتروني غريب. في الحالات الأخيرة ، عندما يتم إنشاء رابط تساهمي ، على سبيل المثال ، الكلور وجزيئات الجلد من الذرات - تكوين بسيط ، يمكن تخزينها في ثمانية إلكترونات.
في كل ثلاثة جزيئات مختلفة (الماء والكلور والحمض) ، يتم إنشاء الرابط التساهمي بين الذرات التي لها نفس القدرة الكهربية. يتم تعزيز هذا التفاعل أثناء التعليم كلمات بسيطة - غير معادنالجزيئات التي تتكون من ذرتين متطابقتين ، وهنا يتم ترتيب الرهانات الإلكترونية بشكل متماثل بين نوى الذرات ، ليتم تشكيلها. بالإضافة إلى ذلك ، تتأسس الجزيئات ، حيث تبدأ مراكز الشحنات الموجبة والسالبة بالنمو.
Otzhe ، الارتباط التساهمي ، الذي يتظاهر بأنه بين ذرات مع نفس العنصر- من الضروري الحفظ ، يتم إنشاء مثل هذا النوع من الصوت الكيميائي في غير المعادن البسيطة. ياك بعقب الفلور بنوع تساهمي غير قطبي ، يمكن أن يسمى الرابط الفلور F2 ، البروم Br2 ، اليود I2 ، النيتروجين N2.
نظرًا لأن الذرات ، نتيجة للترابط ، قد لا تكون سالبة كهربائيًا (ذرات عناصر كيميائية أخرى) ، فإن الزوج الإلكتروني خارج الصندوق يتغير إلى ذرة ذات قدرة كهربائية أكبر. في الوقت نفسه ، يتم تكوين شحنة سالبة جزئية على الذرة مع قدر أكبر من السالب الكهربي ، ويتم تكوين شحنة موجبة جزئية على الذرة ذات قدرة كهربائية أقل. الرسوم الخاصة للقيم المطلقة أقل من واحد.
على سبيل المثال ، عندما يتم إعداد الجزيء على كلوريد حمض الهيدروكلوريك ، يضاف المقطع العرضي للمدار s للذرة إلى المدار p لذرة الكلور. يتم تدوير الزوج الإلكتروني الأولي بشكل غير متماثل بين مراكز الذرات ، والتي تتوافق بشكل متبادل. يستبدل Vona المزيد من الكلور السالب الكهربائي.
تتكون شحنة سالبة جزئية على ذرة الكلور ، وتتكون شحنة موجبة جزئية في ذرة الماء. وهنا لا تضيع جزيئات مركز الشحنات الموجبة والسالبة. تسمى هذه الجزيئات القطبية أو ثنائيات القطب. ثنائي القطب هو نظام من شحنتين متماثلتين بالنسبة للقيمة والعكس بالنسبة للإشارة.
أيضا ، الرابط التساهمي ، الذي ينشأ بين الذرات ، والذي تحدث سلبيته الكهربية ، وإن كان بشكل ضئيل ، يسمى الرابط القطبي التساهمي. من الضروري الحفظ ، يتم إنشاء مثل هذا النوع من الصوت الكيميائي في الكلام القابل للطي ، المعتمد من ذرات غير المعادن. ياك بوت فلوريد HF ، ماء H2O ، أمونيوم NH3 ، ميثان CH4 ، أكسيد الكربون (IV) CO2.
بالنسبة للجزيء ذي النوع التساهمي من الارتباط الكيميائي ، يمكن كتابة صيغة إلكترونية (رسم بياني). تعتمد الصيغة الإلكترونية على رموز العناصر الكيميائية ، بالقرب من نقاط تعيين الرهان الإلكتروني ، وبين الذرات - الرهان الإلكتروني الجاهز. الصيغة الهيكلية (الرسومية) هي صيغة tse ؛ تُظهر الصيغ الإلكترونية والهيكلية من الياك ترتيب تغير الذرات في الجزيئات وروابطها.
الارتباط التساهمي. الارتباط التساهمي القطبي وغير القطبي
مكالمة سرية- سلسلة من الروابط ، وهي بين الذرات لإنشاء أزواج إلكترونية بعيدة (على سبيل المثال ، H2 ، HCl ، H2O ، O2).
وراء خطوة استبدال الأزواج الإلكترونية البعيدة بإحدى الذرات المرتبطة بها ، يمكن أن يكون الرابط التساهمي قطبيًا أو غير قطبي.
أ) اتصال غير قطبي (CNS)- اصنع ذرات واحدة ونفس الشيء عنصر مبتهج- غير معدني (على سبيل المثال ، H2 ، O2 ، O3).
آلية تغطية التوصيل.
تظهر ذرة من الجلد إلى مادة غير معدنية في الغرفة الخلفية لإقران إلكتروني. يتم وضع الرهانات الإلكترونية. يشبه الزوج الإلكتروني الذرات.
آلية محلول جزيء الكلور واضحة:
مخطط إلكتروني لتأكيد جزيء Cl2:
الصيغة الهيكلية لجزيء Cl2:
σ
Cl - Cl ، σ (p - p) - رابط واحد

آلية تكوين الجزيء واضحة:
O2 - كنز.
المخطط الإلكتروني لاعتماد جزيء O2:
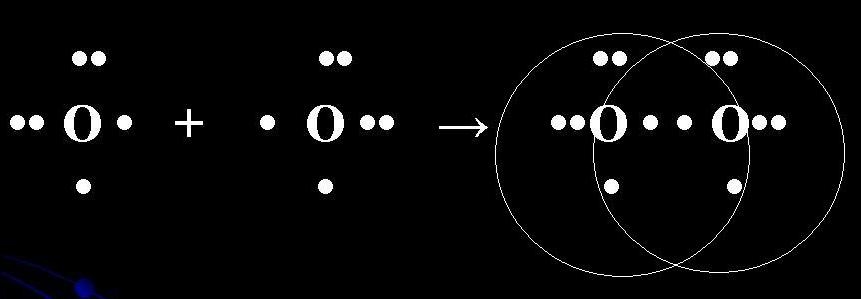
الصيغة البنائية لجزيء O2:
σ
س = س
π
للجزيء رابط فرعي متعدد:
واحد σ (ع - ع)

هذا واحد π (ص - ع)
ب) الفرقة القطبية المتساوية (CPS)- تأكيد ذرات اللافلزات الأخرى ، والتي تعتمد على قيم السلبية الكهربائية (على سبيل المثال ، HCl ، H2O).
هناك نقوش صغيرة ، إذا كان الرابط التساهمي يثبت ذرة بغير فلز ومعدن!
على سبيل المثال ، AlCl3 ، الفرق في الكهربية ∆ E.O.<1.7, т.е. ∆ Э.О.= 3,16 (Cl) – 1,61(Al) = 1,55
الكهربية (EO) - قدرة ذرات عنصر ما على جذب الكهرباء من ذرات العناصر الأخرى إليها. عنصر Nybilsh الكهربية - الفلور F.
يمكن تحويل الطاقة الكهربية بعدة طرق وعن طريق تجميع العناصر في صف لكل نمو. غالبًا ما يكون هناك عدد من العناصر الكهربية المنتصرة ، دعايات من قبل الكيميائي الأمريكي L. Pauling.
طاولة. الكهربية (EO) لعناصر deyakie (مرتبة من أجل تطوير EO).

آلية تغطية التوصيل.
تظهر ذرة الجلد إلى مادة غير معدنية في الجزء الخلفي من المنزل باسمها الخاص ليس إقرانًا للإلكترونيات. يتم وضع الرهانات الإلكترونية. يتم تقليل الزوج الإلكتروني الأولي إلى عنصر سلبي كهربائيًا.
آلية محلول جزيء الكلور والماء واضحة:
НCl - kps.
مخطط إلكتروني لتأكيد جزيء حمض الهيدروكلوريك:

ليس سرا لأي شخص أن الكيمياء هي علم أنيق ، وقبل ذلك ، كانت متعددة الاستخدامات. بدون التفاعلات العالقة والكواشف والكيمياء والمصطلحات القابلة للطي وغير الذكية - يتم الجمع بين جميع الروائح الكريهة واحدة تلو الأخرى. ألي سموت ، سأكون سعيدًا اليوم ، إنه ليس محترمًا ، من سيسمعه قرائنا في ذلك الوقت وبموادهم الجديدة ، أو سأقوم بتخمير الشاي ، والذي قد يكون عملية كيميائية.
يمكنك تغيير visnovok، scho إن كيمياء النبلاء ضرورية بكل بساطةادخل إلى الجديد والنبل ، كقاعدة نورنا ، أو كما هو حول الجزء الأول - tsikavo ، وعلاوة على ذلك ، إنها القرفة.
من المعدي تطوير علاقة بمثل هذا المصطلح ، مثل الرابط التساهمي ، والذي ، قبل الكلام ، يمكن أن يكون قطبيًا أو غير قطبي. قبل الخطاب ، تتظاهر كلمة "تساهمية" باللاتينية "co" - في الحال و "vales" - power.
يظهر المصطلح
لسبب ما لنفسك مصطلح "تساهمية" لأول مرة في عام 1919 روتسي ايرفينغ لانجموير.الحائز على جائزة نوبل. قد يؤدي فهم الانتقال "التساهمي" للحلقة الكيميائية ، في حالة الإساءة إلى الذرة ، إلى حدوث عطل كهربائي ، يُطلق عليه اسم spilny volodinnyam. في مثل هذه الرتبة ، لن يُنظر إليك ، على سبيل المثال ، على أنك معدن ، في أي نوع من الطاقة الكهربائية ، أو كنوع واحد ، في حالة واحدة. الانزلاق يعني حصولك على فكرة غير المعادن.
Vyhodyachy vyshekazanogo ، من الممكن إنشاء visnovok صغيرة حول هؤلاء ، والتي هي في حد ذاتها عملية. توافق Vona winnicks بين ذرات rakhunok على الأزواج الإلكترونية خارج الصندوق ، علاوة على ذلك ، فإنها تفوز بإشارات الاتصال والاستدعاء للإلكترونات.
البس ، كلمات من القطبية:
انظر الرابط التساهمي
أيضًا ، هناك نوعان - الرابط القطبي بالكامل ، والرابط غير القطبي على ما يبدو. الميزات الخاصة للجلد جيدة.
التساهمية القطبية - أوسفيتا
ما هو مصطلح "القطبية"؟
 أطلق عليها اسمًا ، قد تكون ذرتان مختلفتين عن السالبية الكهربية ، لكن الذرات الإلكترونية لا تنتمي إليها في كلتا الحالتين ، ولكن الرائحة الكريهة ستعثر بالقرب من واحدة ، أسفل إلى الأخيرة. على سبيل المثال ، جزيء من ماء الكلور ، في الرابط التساهمي nіy elektroni ، ينمو أقرب إلى ذرة الكلور ، وهو جزء بسيط من السالبية الكهربية في الطعام ، nzh عند الماء. ومع ذلك ، في واقع الأمر ، فإن الفرق في الإلكترونات الثقيلة ليس كبيرًا ، وهو مقدار الوقت الذي يستغرقه نقل الإلكترون إلى الكلور.
أطلق عليها اسمًا ، قد تكون ذرتان مختلفتين عن السالبية الكهربية ، لكن الذرات الإلكترونية لا تنتمي إليها في كلتا الحالتين ، ولكن الرائحة الكريهة ستعثر بالقرب من واحدة ، أسفل إلى الأخيرة. على سبيل المثال ، جزيء من ماء الكلور ، في الرابط التساهمي nіy elektroni ، ينمو أقرب إلى ذرة الكلور ، وهو جزء بسيط من السالبية الكهربية في الطعام ، nzh عند الماء. ومع ذلك ، في واقع الأمر ، فإن الفرق في الإلكترونات الثقيلة ليس كبيرًا ، وهو مقدار الوقت الذي يستغرقه نقل الإلكترون إلى الكلور.
من خلال القطبية ، يتم استبدال الطاقة الكهربائية بأخرى كهربية أكبر ، والنبيذ الجديد له شحنة سالبة جزئية. في قلبها ، في تلك النواة ، التي تكون سلبيتها الكهربية أقل ، هناك جسيم شحنة موجبة محددة.
روبيمو فيسنوفوك:العصافير القطبية ذات اللافلزات الصغيرة ، والتي تستند إلى قيم السالبية الكهربية ، وتنمو الإلكترونات أقرب إلى اللب مع قدر أكبر من السالبية الكهربية.
الكهربية - قدرة بعض الذرات على جذب الإلكترونات إلى نفسها ، مما يؤدي إلى تفاعل كيميائي.
تطبيق القطبية التساهمية، الكلام مع الارتباط القطبي التساهمي:
صيغة Reciovini مع الارتباط التساهمي القطبي
التساهمية غير القطبية ، الفرق بين القطبية وغير القطبية
أنا ناريشي ، غير قطبي ، سنراه قريبًا.
المنظر الرئيسي للغير قطبي من القطبية- تناظر tse. عندما تقترب الإلكترونات القطبية من ذرة واحدة ، ثم مع الحلقة غير القطبية ، تبدأ الإلكترونات في الدوران بشكل متماثل ، بحيث يتم تربيتها في نفس العالم لكليهما.
يشار إلى أن اللاقطبية بين الذرات وغير المعدنية لعنصر كيميائي واحد هي غير قطبية.
على سبيل المثال، الكلام مع الارتباط التساهمي غير القطبي:
وبالمثل ، غالبًا ما يُطلق على سيادة الإلكترونيات ببساطة الفتات الإلكترونية ، أي الروبوتية ، لكن الزحف الإلكتروني ، عند تركيب زوج من الأجهزة الكهربائية ، يتم توزيعه في الفضاء بشكل متماثل ، أو بالتساوي ، في معظم الأحيان.
تطبيق ارتباط تساهمية غير قطبية هذا المخطط لإنشاء ارتباط تساهمية غير قطبية
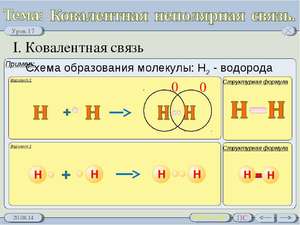
البيرة هي أيضًا نبيلة نبيلة ، حيث تطور التساهمية القطبية وغير القطبية.
تساهمية غير قطبية- رأس ذرة من نفس نوع الكلام. H2. CL2.
في نهاية المقال ، تمت إضافة النهاية ، والآن نعلم ، حسنًا ، إنها عملية كيميائية ، لكن في بداية هذا النوع من الحلم ، تُعرف الصيغ الخاصة باعتماد الخطب ، وبضع كلمات أخرى حول مصباحنا القابل للطي ، ونجاح هذا النوع في العملية.
نوع من الأصوات المبهجة
كوفالنتنا: غير قطبي ، قطبي ، متقبل المانح.
أنا
ميتاليفا
فودنيفا
الارتباط التساهمي
الرابط التساهمي (الرابط الذري ، الرابط المثلي) هو رابط صفيق ، عبارات لإعادة (uzagalnyam) رهانات التكافؤ الإلكترونية. الخمي الإلكترونية (الإلكترونية) ، scho zabechuyut zyazyazyutsya ، تسمى الزوج الإلكتروني الداخلي.
يتم إنشاء رابط تساهمية بسيط مع إلكترونين تكافؤين غير متزاوجين ، لواحد
من ذرة الجلد:
أ + ب ← أ: ب
نتيجة لتحسين النظام الكهربائي ، سيتم ضبط مصدر الطاقة. سيتم إنشاء الاتصال ، حيث يتم تلخيص الطاقة طوال الفترة الزمنية ، وليس في طاحونة الكوز (والفرق في الطاقة لن يكون معدومًا للطاقة ، مثل اتصال الطاقة).
تساهمية غير قطبية (غير معدنية - غير معدنية)
تمامًا كما الذرات ، التي يمكن أن تنشئ رابطًا تساهميًا بسيطًا ، مع ذلك ، فإن الشحنات المرجعية للذرات في الجزيئات هي نفسها أيضًا ، يمكن استخدام شظايا الذرات ، التي يمكن أن تنشئ رابطًا ، لتجاهل زوج إلكتروني. يسمى هذا الارتباط بالرابط التساهمي غير القطبي. قد تكون هذه الحلقة عبارة عن كلمات بسيطة ، على سبيل المثال O2 و N2 و Cl2. ليس فقط غير الفلزات من نفس النوع يمكنها أن تستوعب رابط تساهمي غير قطبي. يمكن أيضًا استخدام الرابط التساهمي غير القطبي للعناصر غير المعدنية ، والسلبية الكهربية لبعض القيم ، على سبيل المثال ، في جزيئات روابط PH3 تساهمية غير قطبية ، Oskіlki EO إمدادات المياه EO الفوسفور.
التساهمية القطبية (EOₐ ≠ EOₓ)
ومع تطور الذرات ، تصبح خطوات فولودين مع زوج مشترك من الإلكترونات فرقًا في كهربية الذرات. فالذرة ذات السالب الكهربي الأكبر ستجذب بقوة أكبر إلكترونين إلى نفسها ، وستصبح هذه الشحنة سالبة. على ما يبدو ، فإن الذرة ذات القدرة الكهربية الأقل للنابوفاك ، مثل هذه الشحنة الموجبة وراء الحجم. إذا كانت هذه مسألة حقيقة ، فهي مسألة نوعين مختلفين من اللافلزات ، ثم يطلق عليها الارتباط القطبي التساهمي .
المتبرع المتقبل
آلية المتلقي المتلقي (آلية التنسيق) هي طريقة لإنشاء رابط كيميائي تساهمي بين ذرتين ، أو مجموعة من الذرات ، وهو أمر مفيد لتطوير زوج غير مرضٍ من ذرة وسلسلة مانحة إلكترونية.
مصطلح "رابط المتبرع - المتلقي" أو "رابط التنسيق" ليس صحيحًا ، ولكنه ليس مجرد نوع من الصوت الخفي ، بل هو نموذج نظري يصف خصوصية التبني. لا تظهر قوة الرابط الكيميائي التساهمي ، الذي تم إنشاؤه لآلية متلقي المانح ، من قوة الرابط الذي تم إنشاؤه للآلية المشتركة (على سبيل المثال ، الرابط N-H-O-NH3).
يصبح الكاتيون غير العضوي المعقد في نصف الوقت دور معدن أحادي التكافؤ. الصيغة الكيميائية هي NH4 +. عند اكتشاف أمياك في نطاق الأحماض ، يحدث التفاعل التالي:
NH3 + H + = NH4 +
^
هيدروكسونيوم (أوكسونيوم ، هيدروكسونيوم) НзО + هو أيون معقد ، ينتقل من البروتون إلى جزيء من الماء.
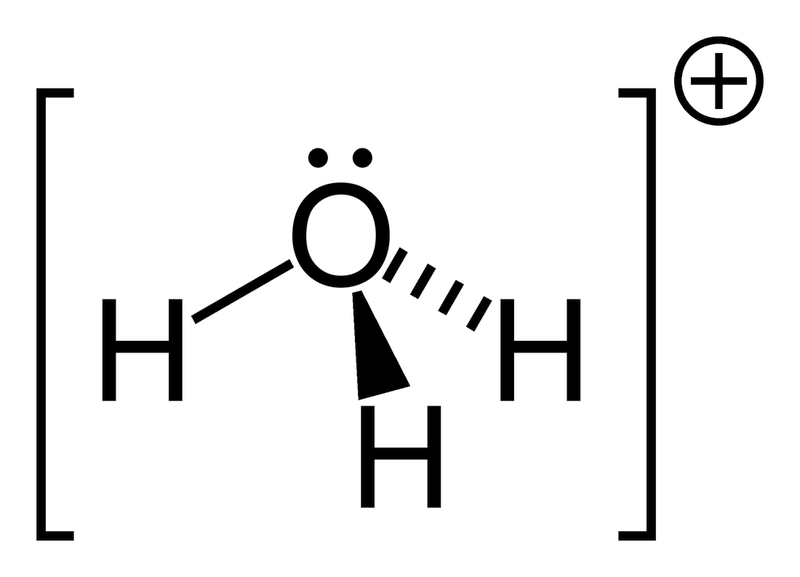
يتبرع المتبرعون بالذرات للنيتروجين والحامض والفوسفور والسيركي وغيرها. يمكن أن يكون دور المستقبِل هو تأين الذرة بالماء H + ، فعل p-metal (على سبيل المثال ، الألومنيوم بموافقة أيون AlH4-) ، وخاصة العنصر d ، الذي قد لا يضيف طاقة إلى جهاز التكافؤ الإلكتروني.
يصف موقع آلية متلقي المانح إنشاء روابط تساهمية موضعية في الجزيئات والأيونات الجزيئية للعمليات المعقدة (التنسيق): يتم تشكيل الروابط لزوج غير معزول من معقد الطاقة الكهربائية والذرة تعتبر آلية المتبرع والمقبول مسؤولة أيضًا عن إنشاء تفاعلات المنتجات الوسيطة (الوسائط) ، على سبيل المثال ، المجمعات ذات الشحنة المنقولة.
إن نموذج آلية المتبرع المتلقي هو في إطار ظاهرة التكافؤ وتوطين الطاقة الإلكترونية عند إنشاء الروابط التساهمية (طريقة مخططات التكافؤ). عند حدود طريقة المدار الجزيئي ، ليس من الضروري استهلاكه من مظاهر أخرى.
^
ثانيًا. خاتم ايوني (معدن-غير معدني)
رابط Ionny عبارة عن حلقة كيميائية باردة ، يمكن إنشاؤها بين الذرات بنمو كبير ( >1,7
على مقياس باولينج) الكهربية ، عندما يكون هناك زوج إلكتروني ، سأذهب غالبًا إلى الذرة بسلبية كهربائية أكبر. سعر الكثير من الطاقة مشحون. يمكن استخدام بعقب لـ CsF ، حيث تصبح "درجات التأين" 97٪ ، ومن الواضح كيفية إلقاء الضوء على المؤخرة باستخدام كلوريد الصوديوم NaCl. يمكن تحديد التكوين الإلكتروني لذرات الصوديوم والكلور: 11 Na 1s2 2s2 2p 6 3s1 ؛ 17 Cl 1s2 2s2 2p6 Зs2 3р5
ذرات الياك تسي ، سباقات الطاقة غير المكتملة. من الواضح أن الإنجاز النهائي لذرة الصوديوم أسهل في تلقي إلكترون واحد ، وليس قادمًا ، وبالنسبة إلى ذرة الكلور فمن الأسهل الوصول إلى إلكترون واحد ، وليس قادمًا. مع التفاعل ، ستزداد ذرة الصوديوم إلى إلكترون واحد ، وسيتم امتصاص ذرة الكلور. من الناحية التخطيطية ، يمكن كتابة السعر على النحو التالي: Naº - l e -> Na +і على الصوديوم ، غلاف stіyka ثمانية إلكترون 1s2 2s2 2p6 لـ rakhunok من rіvnya نشط آخر.
Clº + 1E → Cl¯- أيون للكلور ، كومة من غلاف ثماني الإلكترونات. بين الأيونات Na + و Cl- ، يوجد عبء إلكتروستاتيكي ، ويتم إثبات النتيجة. الرابط الأيوني هو النوع المتطرف من الاستقطاب للرابط التساهمي القطبي. مؤكدة بين المعدن النموذجي وغير المعدني.
مع مجموعة كبيرة من الإلكترونيات ، سيتحول المعدن إلى غير معدني. التأكيد هو المسؤول عن الجزء.
إذا تم اعتماد الارتباط الكيميائي بين الذرات ، فهناك زيادة أكبر في السلبيات الكهربائية (EO> 1.7 لـ Poling. نتيجة لهذا є تأكيد لعملية شحن الأيونات الأخرى:
Mіzh іons ، تبنت scho ، الفوز صعب إلكتروستاتيكيًا ، حيث يُطلق عليه صوت іonny. بتعبير أدق ، مثل هذه النظرة. في واقع الأمر ، فإن الارتباط بين الذرات في منظور نقي لا يمكن أن يتحقق في أي مكان ، أو حتى في أي مكان ، من أجل ذلك ، تكون الروابط صغيرة الحجم وذات طابع تساهمي. في تلك الساعة بالذات ، يمكن غالبًا جعل أجراس الأيونات الجزيئية القابلة للطي أيونية بحتة. من ناحية أخرى ، هناك اختلاف في جانب الاتصال الأيوني مع أنواع الكيمياء الأخرى ، يظهر الاتصال في عدم الاتجاهية وعدم التشبع. البلورات نفسها ، المعتمدة للصوت الأيوني ، ثقيلة حتى التعبئة الجديدة للسابقات.
السمة المميزة لهذه spoluks هي razchinnist جيدة في القطبية razchinnik (الماء والأحماض والرقيقة). يتم نقل السعر من خلال شحن عناصر الجزيء. مع وجود الكثير من ثنائيات أقطاب الموزع ، فإنها تنجذب إلى الأطراف المشحونة للجزيء ، ونتيجة لذلك ، "تمدد" جزيء الكلام إلى جزء يشعر به ، دون إعطاء أي معرفة بـ هو - هي. ستكون النتائج على شكل ثنائيات أقطاب الموزع. 
^ حزام معدني
الحلقة المعدنية عبارة عن حلقة مبهجة ، الأزيز ظاهرة من مجموعة واسعة من الأجهزة الإلكترونية. الياك هي خاصية مميزة للمعادن النقية ، وكذلك السبائك والسبولوك المعدني.
آلية الربط المعدني
في جميع جامعات الكرات البلورية ، يتم سرد الأفكار الإيجابية للمعادن. فيما بينها ، ينهار تكافؤ الإلكترونات كما لو كان جزيئات غازية ، كما لو أن الذرات شوهدت عند الموافقة على الأيونات. تلعب Tsі elektroni دور الأسمنت ، وتشبع بشكل إيجابي في آن واحد ؛ في المقام الأول ، سقطت المكافآت من الطريق لبذل القليل من الجهد للتخلص منها. في الوقت نفسه ، تمتلئ الإلكترونيات بالأيونات الموجودة في حدود الكرات البلورية ولا يمكن تركها. إذا لم تكن المكالمة مترجمة وغير مباشرة. لذلك ، هناك أرقام تنسيق أعلى (على سبيل المثال ، 12 ساعة و 8).
يمكن استخدام عدد كبير من المعادن لواحد من الكرات المتناظرة المتقدمة مع تعبئة واحدة من الذرات:
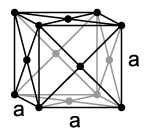
مكعب حجمي متمركز ، مكعبة الوجه وسداسية.
في المشابك المركزة ذات الحجم المكعب (BCC) ، يتم وضع الذرات في قوائم عند رؤوس المكعب وذرة واحدة في وسط المكعب. قد تكون الشبكات ذات الحجم المكعب معدنية: Pb و K و Na و Li و β-Ti و β-Zr و Ta و W و V و α-Fe و Cr و Nb و Ba و ін.

في المشابك المكعبة المتمركزة على الوجه (FCC) ، يتم وضع الذرات في قوائم في أعلى المكعب وفي وسط وجه الجلد. قد تكون المشابك من هذا النوع معدنية: α-Ca و Ce و α-Sr و Pb و Ni و Ag و Au و Pd و Pt و Rh و γ-Fe و Cu و α-Co و ін.
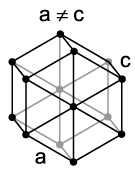
في الشبكة السداسية ، يتم وضع الذرات على قمة مراكز القواعد السداسية ذات المنشور ، وثلاث ذرات في المنطقة الوسطى مع مناشير. قد تكون هذه الحشوة من الذرات معدنية: Mg و -Ti و Cd و Re و Os و Ru و Zn و -Co و Be و -Ca و ін.
قوة
Electroni ، scho volno للانهيار ، إضافة طاقة عالية وموصلية حرارية. الخطابات ، التي قد تسبب روابط معدنية ، غالبًا ما تجمع بين قوة اللدونة ، لأنه عندما تتغير الذرات ، لا يرى أحدهما والآخر تمزق الروابط.
^
رابعا. خاتم مائي
خاتم مائي- شكل الارتباط بين ذرة كهربية وذرة ماء H ، مرتبطة تساهميًا مع ذرة كهربية. يمكن أن تكون الذرات الكهربية إما N أو O أو F. ويمكن أن تكون روابط الماء بين الجزيئات أو داخل الجزيئات.
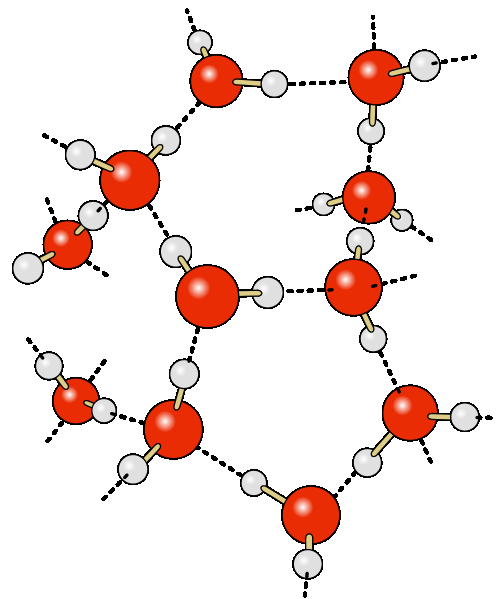
في كثير من الأحيان ، تبدو الحلقة المائية وكأنها تفاعل إلكتروستاتيكي ، مدعوم بكمية صغيرة من الماء ، مما يسمح بالاقتراب من ثنائيات الأقطاب المترابطة. وهذا يعني عن نوع رابط متلقي-مانح ، وهو غير متكافئ بالاقتران مع ذرة H ، ويرتبط تساهميًا بالذرة A جماعية A-Hالجزيء RA-H والذرة السالبة كهربائيًا B للجزيء (أو مجموعة وظيفية من نفس الجزيء) BR ". نتيجة هذه التفاعلات هي مركب RA-H BR" بدرجة مختلفة من الاستقرار ، حيث تظهر الذرات باعتبارها "جسر" شظايا RA و BR ".
خصوصيات صوت الماء خلف أوكريمي فيجلياد، є її ليس أسوأ من ارتفاع tsnіst ، الاتساع والأهمية ، خاصة في المجالات العضوية ، وكذلك الإجراءات آثار جانبيةكروشيه بأحجام صغيرة ومجموعة واسعة من الإلكترونات الإضافية بالقرب من الماء.
طاقة الرابط المائي أقل بكثير من طاقة الرابط التساهمي (لا يتغير 40 كيلو جول / مول). من ناحية أخرى ، هناك طاقة كافية لانتصارات اتحاد الجزيئات ، بحيث يتم دمجها في ديميري أو بوليميري. ارتباط الجزيئات نفسها غير طبيعي درجات حرارة عاليةذوبان هذه الأنهار وخبزها ، مثل فلوريد الهيدروجين والماء والأمونيا.
إن الرباط من النوع الذي يكون ضعيفًا بالنسبة للروابط الأيونية والتساهمية ، البروتيا ، هو أكثر أهمية في التفاعلات الداخلية وبين الجزيئات. أصوات Vodnevі غنية بما يجب تكبيره القوة البدنيةيقود المركبات العضوية التي تحتوي على باجاتوخ (الكحوليات ، والأحماض الكربوكسيلية ، وأحماض الأمونيوم الكربوكسيلية ، والإيثرات القابلة للطي).
بشكل غير طبيعي في الهواء ، سيتم منع حرارة الماء والتوصيل الحراري للكحولات الذرية الغنية بواسطة أصوات الماء الرقمية. يمكن أن يتكون جزيء واحد من الماء من بعض الروابط والمعلقات الكلاسيكية من الماء إلى الماء.
تعمل روابط الماء على زيادة درجة حرارة الغليان واللزوجة والتوتر السطحي. يدعو Vodnevі іdpovіdalі للقوى الفريدة الوفيرة للمياه.
بسبب المظاهر العرضية ، يمكن أن يؤدي ظهور الوصلات القائمة على الماء بين جزيئات الماء إلى تكوين مجموعات أو مجمعات مائية. يمكن أن يكون أبسط بعقب لمثل هذه المجموعة محركًا باهتًا:
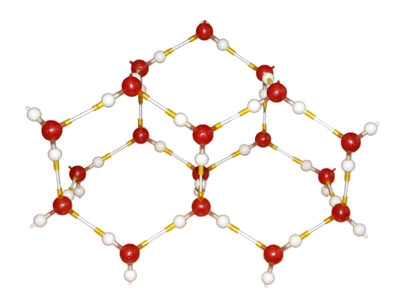
ماء є بواسطة شبكة من جزيئات H2O ، مع روابط مائية.

عندما يتم تجميد الماء ، يبدو الماء كثيرًا:
![]()
روابط الماء في جزيئات الجليد:
روابط الماء بين جزيئات الأحماض العضوية:

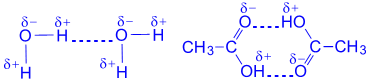
مكالمات المياه على البنوك:

